인체안전성을 위한 족두리풀 천연추출물의 독성평가
Toxicity Evaluation of Asarum sieboldii Extract for Human's Safety
Article information
Abstract
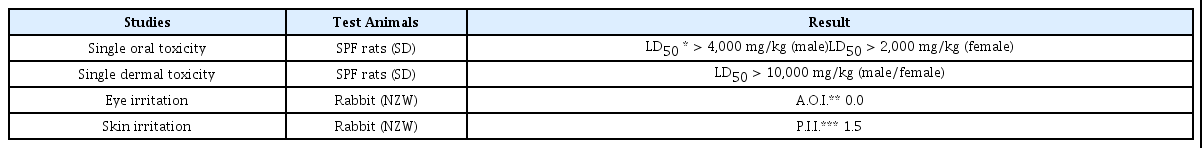
국내 문화재 생물피해 방제는 농약에서 유래한 화학적 약제를 사용하여 왔다. 그러나 인체와 환경에 대한 유해성 문제로 인하여 사용이 점차 제한되고 있으며, 새로운 방제약제의 탐색과 안전성 연구에 대한 관심이 지속적으로 증가되 고 있다. 개발된 천연 생물방제제의 안전성은 동물실험을 통한 독성평가로 확인하고 있으며, 치사량과 자극성 평가를 위하여 경구독성, 경피독성, 안점막자극 및 피부자극 시험법을 이용하여 안전성을 평가한다. 독성평가를 위해 실험용 쥐와 토끼를 이용하며, 쥐에 대해 단회 경구독성과 경피독성 시험을 실시하고, 토끼에 대해 안점막자극시험 및 피부자극 시험을 시행한다. 본 시험에 이용한 천연 생물방제물질은 목재부후균과 흰개미에 대한 항진균활성 및 살충활성이 조사 된 족두리풀 추출물을 적용하였다. 쥐에 대한 단회 경구투여한 결과 LD50 값이 수컷 4,000 mg/kg 이상, 암컷 2,000 mg/kg 이상으로 판정되었으며, 단회 경피 투여한 결과 LD50 값이 암수 모두 10,000 mg/kg 이상으로 판정되었다. 토끼의 눈에 대한 자극시험에서는 무자극성으로 판정되었으며, 피부에 대해서는 약한 자극성이 있는 물질로 판단되었다. 본 연구를 통해 천연 생물방제물질인 족두리풀 추출물의 안전성을 동물실험으로 확인함으로써 화학 물질의 안전성 검증을 위한 기본적인 유해성 평가 방법으로 제시하고자 한다.
Trans Abstract
Chemically derived pesticides have been used to prevent biological damage to domestic cultural property. However, their use is gradually being restricted due to the harmful effects on the human body and environment. Therefore, there is a growing interest in the search for new antifungal biopharmaceuticals whose safety has been confirmed by toxicity evaluation through animal experiments. This paper presents methods of toxicity evaluation of natural biocides using Sprague-Dawley rats and New Zealand White (NZW) rabbits. Safety of the natural biocide extract of Asarum sieboldii was evaluated using single-dose oral and dermal toxicity tests in Sprague-Dawley rats, and eye and skin irritation tests in NZW rabbits. The extract has proven antimicrobial and insecticidal activities against wood-rotting fungi and termites. After single oral administration to rats, the LD50 values were determined to be over 4,000 and 2,000 mg/kg for males and females, respectively. After single dermal administration to rats, the LD50 values exceeded 10,000 mg/kg for both males and females. The extract was identified to be non-irritant to the rabbit eye, and only slightly irritant to the rabbit skin. In this study, we confirmed the safety of the A sieboldii extract through animal testing. Due to the harmfulness of humidifier disinfectants, focus is on the safety of chemical pesticides, and toxicity evaluation is suggested as the basic method for hazard evaluation.
1. 서 론
국내에 목조건축물에 대한 생물피해 방제는 1980년대 방수포 등으로 피복하는 피복 훈증처리법을 적용하여 Methyl bromide와 Ethylene oxide 혼합가스를 이용한 훈증을 통한 대규모 생물피해 방제를 시작하였다(Cultural Heritage Administration, 1985). 훈증처리는 휘발성 살충 및 살균 약 제를 사용하여 구조가 복잡하고 재질이 취약한 유물에 직 접 처리하는 것이 아니므로 균일한 살충·살균처리가 가능 하였으며, 처리 후 약제가 빠른 속도로 증발하여 약제와 재 질간의 접촉시간이 짧아 문화재 재질에 영향을 주지 않고 가해 생물만을 제어할 수 있다는 장점이 있다. 이로 인해 훈증처리법이 보편적으로 적용되기 시작했으며, 1990년대 국가적 관심이 증대되어 1991년 장말손 종손가 고문서고 등 11개소, 1993년 남원 광한루 등 6개 지역과 창덕궁 유물 창고 등 10개소에 대대적인 훈증처리 사업이 시행되었다 (Cultural Heritage Administration, 2012). 2000년대에는 기 후 변화로 한반도의 기온이 높아져 목재문화재를 손상시키 는 대표적인 가해 곤충인 흰개미목과 딱정벌레목에 의한 피해가 증가되어 대책마련을 위한 전국 목조문화재에 대한 생물피해 전수조사 및 모니터링 조사가 실시되고 있다 (National Research Institute of Cultural Heritage, 2013).
한편 문화재 생물피해 방제 약재로 사용되어 왔던 Methyl bromide가 1997년 9월 캐나다에서 채택된 '오존층 파괴 물 질에 관한 몬트리올 의정서(The Montreal Protocol on Substances that Deplete the Ozone Layer)'에 의거하여 대기 환경에 유해한 규제 대상 물질로 지정됨에 따라 선진국은 2005년, 개발도상국은 2015년부터 사용이 금지되므로 전 세계적으로 Methyl bromide를 대체할 새로운 방제 약제 및 방법이 요구되었다(United Nations Environment Programme, 1997). 또한 문화재에 적용되는 화학약제는 휘발성 유기 화 합물로 인체에 유해한 성분을 개방된 공간에서 사용함으로 인해 관람객과 문화재 관리 직원의 건강에 대한 우려가 제기 되고 있다. 최근의 국내연구에서 Environmental Protection Agency(EPA, 미국환경청)의 독성 등급에 따른 국내외 주 요 문화재 생물피해 방제 약제의 성분 47종(살충방충제 21 종, 살균방균제 18종, 훈증제 8종)의 유해성을 평가한 결과, 이중 12종이 지극히 유독한 것으로 나타났으며 10종이 극 히 유독, 10종이 매우 유독한 것으로 평가되었다(Kang et al., 2013). 특히 Methyl bromide의 대체 약제로 언급되는 Ethylene oxide는 최고등급 발암물질에 속하며 국내 대기 환경 보전법에 대기환경 오염물질로 분류되어 있다. 이처 럼 화학적 방제법은 저렴하고 신속하게 생물피해 방제가 가능하다는 장점이 있지만 살생물제라는 특성상 독성 성분 을 기반으로 하므로 인체와 환경에 무해한 약제를 선정하 기가 어렵다. 이로 인해 천연 약제를 이용한 생물피해 방제 제 개발 연구도 진행되었으며, 1999년 전통 한약제인 정향, 유향 및 팔각회향에서 방충·방균성이 우수한 물질을 개발 하였다(Chung et al., 2001). 이후 식물성 허브에서 살충 및 살균력이 있는 천연 생물피해 방제제 개발연구가 꾸준히 진행되었으며, 족두리풀로부터 문화재 재질에 영향을 주지 않는 방충·방균성 물질을 개발하였다(National Research Institute of Cultural Heritage, 2014).
가습기 살균제 사고(Choi et al., 2012) 이후 인간과 환경 에 직접 노출되어 피해가 우려되는 살생물제에 대한 관리 방안의 필요성이 제기되어, 환경부에서 화학물질 등록 및 평가에 관한 법률(화평법)를 제정하여 살생물제에 사용되 는 활성성분의 등록 및 살생물제품의 평가, 안전 및 표시 기준을 적용하여 관리하기로 하였다(Ministry of Environment, 2015). 유럽은 살생물제 활성성분 및 살생물제품 관리를 위 해 1998년 살생물제 관리지침(Biocides Products Directive, Directive 98/8/EC, BPD)을 제정하여 시행하였으며, 이를 2013년 회원국 수준이 아닌 유럽 전역에 일괄적으로 적용 되는 살생물제 관리법(Biocidal Products Regulation, Regulation (EU) 528/2012, BPR)로 강화하여 적용하고 있다(Health and Safety Executive, 2012). BPR에 따라 살생물제 활성성 분에 대한 등록 및 평가를 받도록 하며, 국내 화학물질 등 록 및 평가에 관한 법률과는 달리 이를 함유하는 살생물제 품에 대해서도 안전성 평가 자료를 준비하여 허가를 받도 록 규정하고 있다. 국내 화학물질 등록 및 평가에 관한 법 률과 유럽 기준인 BPR과 비교 시 인체독성에 대해서는 제 품유형별 안전성평가 항목의 차이는 확인되지 않으며, 인 체독성 항목에서 급성독성(급성경구독성, 급성경피독성, 급성흡입독성), 피부자극성 및 눈자극성, 유전독성, 반복투 여독성(28일) 등에 대하여 동일한 필수 자료를 요청하고 있다.
국내 관련 부처에서 관리되는 살생물제에 대하여 검토 한 결과, 식품의약품안전처는 약사법에 따른 의약부외품으 로 구제제, 방지제, 기피제, 유인살충제가 관리대상이며, 식품위생법에 따른 식품용기 포장 및 살균제가 해당된다. 또한 농림축산식품부는 동물용 의약품 등의 취급 규칙에 따라 동물 위생용 살생물제와 축사소독제가 해당되며, 그 외 환경부의 먹는물 관리법에 따른 식수처리제, 해양수산 부의 해양환경관리법에 따른 방오제, 산림과학원의 목재방 부제가 관리대상이 된다(Korea Environment Institute, 2014). 아직 문화재에 처리되고 있는 화학약제에 대한 관리법이 시행되고 있지 않아 생물피해 방제제의 인체독성에 대한 평가 자료를 요구하고 있지 않으나, 문화재는 관람객과 문 화재를 관리하는 직원들에게 접근성이 쉽고 노출 위험성이 높기 때문에 독성평가를 통한 안전성 검증은 필수 항목이 라 할 수 있다. 따라서 본 연구에서는 화학물질 등록 및 평 가에 관한 법률의 인체독성 항목에서 급성독성에 해당하는 급성경구독성과 급성경피독성, 피부자극성 및 눈자극성 평 가를 실시하여 그에 대한 방법 및 결과에 대하여 기술하였다.
2. 연구 재료 및 방법
2.1. 시험물질
본 연구의 시험물질(Asarum sieboldii extracts)은 국립문 화재연구소 유기질 문화재 보존 천연 살생물제 개발 연구 에서 개발된 천연 생리활성소재로 목재부후균과 흰개미에 대하여 항진균 활성과 살충활성이 우수한 것으로 알려져 있다. 목재부후균 4종(Coniophora puteana, Lentinus lepideus, Postia placenta, Trametes versicolor)을 대상으로 측정한 항진균 활성은 디스크 당 1.50∼2.84 μl의 분포에서 50% 억제효과를 나타내었으며, 흰개미에 대해서는 4 mg/mL 농 도에서 68.3%의 살충율을 나타내었다(National Research Institute of Cultural Heritage, 2010; Kang et al., 2012). 본 연구에서는 문화재 처리 시 누적용량을 산정하여 시험물질 의 농도를 높게 설정하였으며, 예비실험을 통하여 최고 농 도를 확정하여 시험을 진행하였다.
2.2. 동물실험
본 연구는 Good Laboratory Practices(GLP) 인증기관인 ㈜바이오톡스텍에 위탁하여 “비임상시험관리기준” 식품 의약품안전청 고시 제2009-183호(2009년 12월 22일)와 OECD test guideline에 따라 시행되었으며(OECD, 2002), 본 연구 에 그 시험방법에 대하여 자세히 기술하였다. 본 동물시험 에 사용된 시험계는 단회 경구투여 및 단회 경피투여 독성 시험에 Sprague-Dawley계 특정병원성 부재(Specific Pathogen- Free)의 5주령 된 암수 흰쥐를 오리엔트바이오로부터 분양 받아 6일간 순화기간 동안 증상관찰 등을 시행하여 정상적 인 동물만 시험에 사용하였고, 안점막 및 피부자극시험은 New Zealand White(NZW)계 10주령 수컷 흰토끼를 순화 기간을 거쳐 시험에 사용하였다.
2.2.1. 단회 경구투여 독성시험
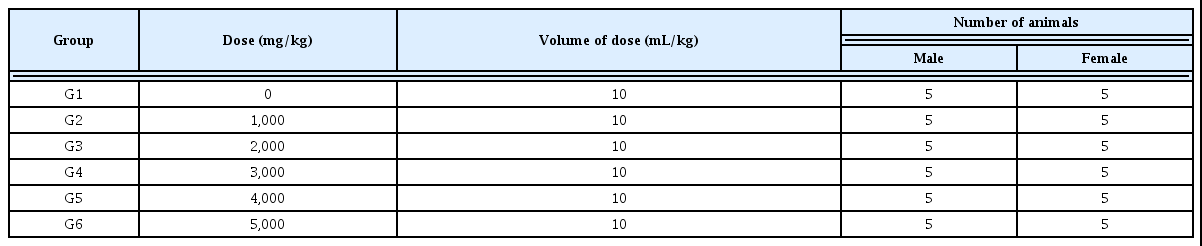
단회 경구투여 시험군의 구성은 실험실 환경에서 1주간 적응시킨 실험동물을 대조군과 시험물질 투여군으로 나누 어 각 군은 암, 수 각각 5마리로 하였다. 투여액량은 10 mL/kg으로 하였고, 개체별 투여액량은 절식 후(투여당일) 의 체중을 기준으로 산출하였다. 경구투어용 존데를 부착 한 일회용 주사기(3 mL)를 이용하여 위내에 단회 강제 투 여하였다. 모든 동물은 투여 전에 약 16시간 이상 음수는 자유섭취 시키면서 절식시키고, 투여 후 약 4시간 후에 사 료를 급여하였다.
투여용량 설정은 예비시험으로 10,000, 5,000, 4,000, 3,000, 2,000 및 1,000 mg/kg을 암수 각 1마리에 단회 경구 투여한 결과, 10,000 및 5,000 mg/kg 용량에서 암수 각 1례, 4,000 및 2,000 mg/kg 용량에서 암컷 1례의 사망례가 관찰 되었다. 따라서, 본 시험의 투여용량은 사망이 관찰된 최대 용량인 5,000 mg/kg을 고용량으로 설정하고, 2,000, 3,000 및 4,000 mg/kg을 중용량 1, 2 및 3으로 설정하고, 1,000 mg/kg을 저용량으로 설정하였다. 대조군에는 시험물질 투 여군과 동일한 액량의 부형제를 투여하였다(Table 1).
2.2.2. 단회 경피투여 독성시험
단회 경피투여 시험은 투여당일의 투여 전 체중을 기준 으로 투여액량을 산출하였다. 투여전일 제모기(5000ADII, NATUME, Japan, Size: 0.05 mm)를 이용하여 등쪽 피모를 제모하였다(약 6×6 cm). 제모부위의 5×5 cm 넓이를 투여 부위로 하였다. 시험물질을 린트포에 도포한 후, 투여부위 에 부착하였다. 그리고 Soft Cloth Tape with Liner(폭 5 cm, 3M Co., Ltd., Korea)로 고정하였다. 도포 24시간 경과 후, 린트포 및 Soft Cloth Tape with Liner를 제거하고 피부에 남은 시험물질은 적절한 미온수를 이용하여 닦아내었다. 대조군에는 린트포 및 Soft Cloth Tape with Liner를 시험물 질 투여군과 동일하게 처치하였다.
투여용량설정은 예비실험으로 경피 시험에서 투여 가능 한 최대 용량인 10,000 mg/kg을 암수 각 1마리에 단회 경피 투여한 결과 사망례가 관찰되지 않아, 10,000 mg/kg의 단 일 시험물질 투여군을 설정하였다(Table 2).
2.2.3. 안점막 자극시험
NZW계 토끼는 자극성 시험에 널리 사용되고 있으며, 축적된 시험자료가 풍부하므로 선택하였다. 시험동물 입수 시 모든 동물의 일반증상을 관찰하고, 체중을 측정하였다. 8일간의 순화기간 중에 매일 1회 일반증상을 관찰하였다. 순화기간 종료일에 체중을 측정하고, 일반증상관찰 및 체 중변화를 확인하여 동물의 건강상태 이상이 없는 것을 확 인하였다.
시험군은 비세안군과 세안군으로 나누었으며, 비세안군 은 토끼의 우안 아래 눈꺼풀(하안검)을 안구로부터 멀리 당 겨 컵모양을 형성시키고, 이 결막낭 내에 시험물질원액 0.1 mL를 1 mL 주사기를 이용하여 1회 점안하였다(Table 3). 약 1초간 감은 상태를 유지시켜 시험물질의 손실을 방지하 였다. 좌안은 무처치 대조안으로 하였다. 세안군은 비세안 군과 동일한 방법으로 시험물질원액 0.1 mL를 우안의 결 막낭내에 1회 점안하고, 30초 후 20 mL의 생리식염 주사액 (Choongwae Pharma Corp., Korea)으로 1분간 눈에 자극을 주지 않을 정도의 속도로 세안하였다. 좌안도 20 mL의 생 리식염 주사액으로 1분간 세안을 실시하여 세안 대조안으 로 하였다.
2.2.4. 피부 자극시험
피부자극시험 또한 안점막 자극시험과 마찬가지로 NZW계 토끼를 이용하였으며, 시험동물 입수 시 모든 동물 의 일반증상을 관찰하고, 체중을 측정하였다. 8일간의 순 화기간 중에 매일 1회 일반증상을 관찰하였다. 순화기간 종료일에 체중을 측정하고, 일반증상관찰 및 체중변화를 확인하여 동물의 건강상태 이상이 없는 것을 확인하였다.
시험물질의 피부폭로에 의한 안전성을 평가하기 위한 경피투여는 제모한 토끼의 경배부 정중선을 대칭축으로 해 서 좌·우 각 2부위, 합 4부위(1부위는 약 2.5×2.5 cm)를 투 여부위로 하였다. 그 중 2부위를 비찰과부위, 그 외 2부위 를 찰과부위로 하였다. 찰과부위는 18G 주사침을 이용하 여 표피만 손상되고 진피는 손상되지 않으며 피가 나지 않 을 정도의 # 모양의 찰과상을 만들었다(Figure 1).
시험물질원액 0.5 mL를 1 mL의 주사기를 이용해서 2.5×2.5 cm의 패치(PIP-TOKYO Co., Ltd., Japan)에 균일하게 도포 하고, 시험물질 투여부위의 비찰과 및 찰과 부위에 1회 적 용하였다. 무처치 대조부위의 비찰과 및 찰과 부위에는 패 치만을 1회 적용하였다. 투여부위 전체를 거즈(DaeHan Medical Supply Co., Ltd., Korea)로 덮고, 의료용 투명 반 창고(3M Tegaderm Transparent Dressing, Original Frame Style, 3M Co., Ltd., Korea)로 감았다. 양쪽을 종이테이프 (Masking Tape, DAESUN Com., Korea)로 다시 한 번 고정 해서 24시간 동안 폐색첩포하였다. 24시간 경과 후, 패치를 제거하고, 미온수를 적신 거즈 및 마른 거즈를 이용하여 남 아있는 잔류물을 제거하였다.
2.3. 관찰 항목
2.3.1. 단회 경구 및 경피 독성 평가
단회 경구 및 경피 독성시험 시 투여당일(0일)에는 30 분, 1, 2, 4 및 6 시간째에 일반상태(독성징후의 종류, 발현 시기, 회복시기 등) 및 사망유무를 관찰하였다. 투여 후 1일 부터 14일까지는 매일 1회 일반증상을 관찰하였다.
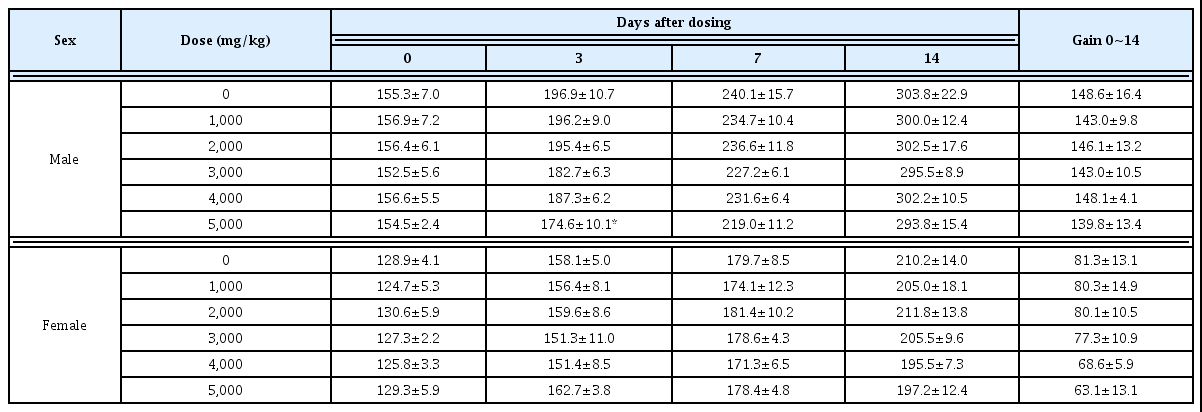
체중측정은 투여당일(투여 전), 투여 후 1, 3, 7일 및 14 일(부검일)에 측정하였다.
2.3.2. 안점막 자극 시험의 안구병변 및 안자극성 평가
안구병변 관찰은 투여 1, 2, 3, 4 및 7일에 각막, 홍채 및 결막에 대해 육안 및 Slit lamp (Kowa SL-15, KOWA Co., Ltd., Japan)로 관찰하고, ‘Draize의 안구병변의 등급(Draize, 1959)’에 따라서 평가하고 기록하였다. 또한 투여 후 24시 간(투여 1일)에 플루오레세인 시험지를 이용하여 각막이상 의 유무에 대해서 관찰하였다. 투여 7일에 안구병변이 관 찰되지 않았기 때문에 실험을 종료하였다.
안자극성 평가는 관찰시간별로 개체별 각 관찰부위의 평점을 합산한 합계평점인 Individual Index of Ocular Irritation(I.I.O.I.)을 구하고, 각 개체별 합계평점의 합을 마 리수로 나눈 값(Mean Index of Ocular Irritation(M.I.O.I.)을 구하였다. 투여 후 1, 2, 3, 4일 및 7일의 M.I.O.I.의 최대값 인 Index of Acute Ocular Irritation(I.A.O.I.)을 구하고, I.A.O.I. 및 Day 7 I.I.O.I. 등의 값으로 Guillot의 ‘안점막자 극 평가표(Guillot, 1982)’에 따라서 안점막 자극성의 정도 를 평가하였다.
2.3.3. 피부 자극 시험의 피부반응 및 피부 자극성 평가
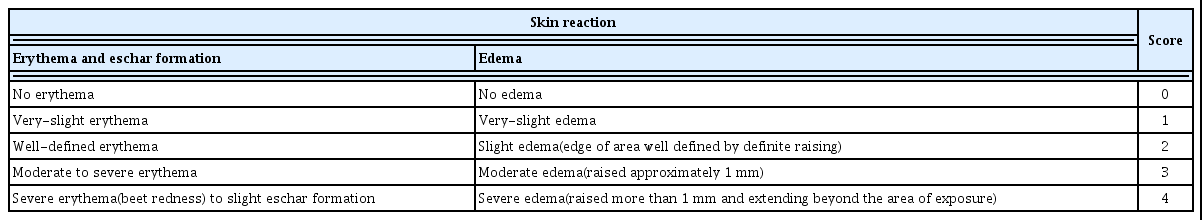
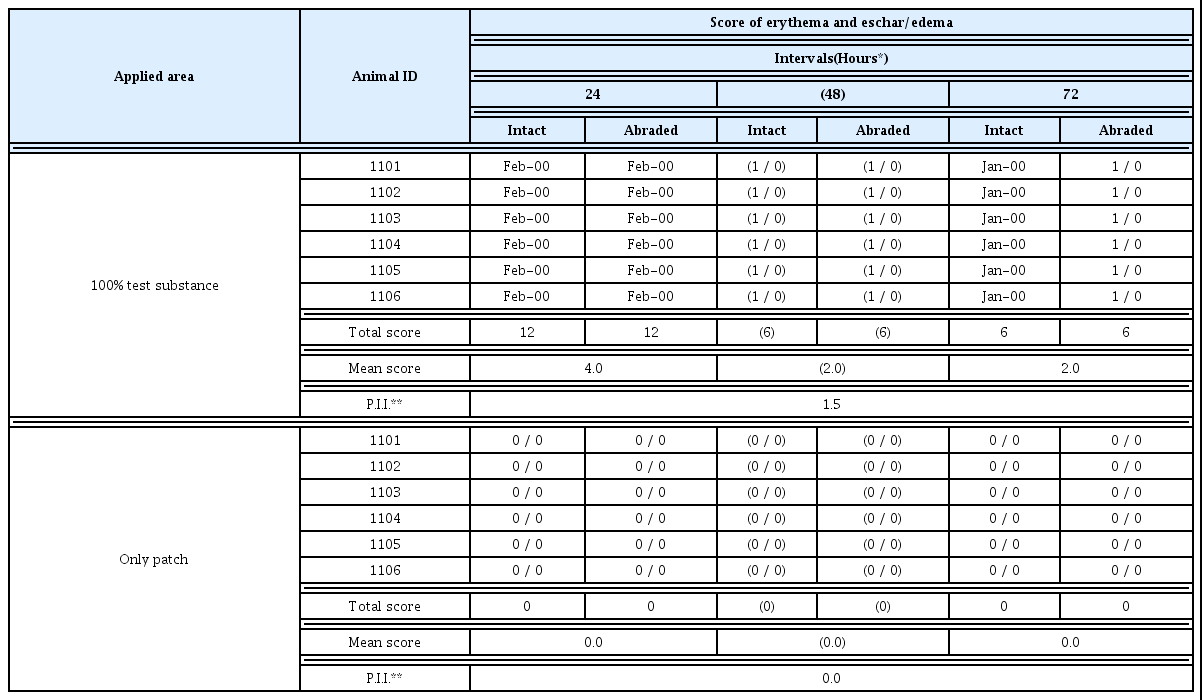
피부 반응 평가는 시험물질 투여 후 24, 48, 72시간에 홍 반과 가피형성 및 부종형성에 대해서 관찰하고, 다음의 ‘Draize의 피부반응 평가표(Draize, 1959)’에 따라서 평가 하였다(Table 4).
피부 자극성 평가는 시험물질의 1차 피부자극지수(Primary skin Irritation Index, P.I.I.)를 구하여 자극의 정도를 평가하 였다. 1차 피부자극지수는 투여 후 24 및 72시간에 비찰과 및 찰과 부위의 홍반과 가피형성 및 부종형성의 평균점수 를 관찰횟수×투여부위수(2×2)로 나누어 산출하였다. 그 수 치로부터, 다음의 ‘피부자극정도의 분류’에 따라 자극정도 를 분류하였다(Table 5).
2.4. 통계 처리
단회 경구투여 독성시험의 통계처리는 실험에서 얻어진 체중 결과는 SAS(version 9.2, SAS Institute Inc., USA)를 사용하여 검정하였고 Bartlett test를 실시하여 등분산성을 검정하였다(유의수준: 0.05). 그 결과치가 등분산인 경우, One-way analysis of variance(ANOVA)를 실시하여 유의성 (유의수준: 5%)이 관찰되면 Dunnett's t-test의 다중검정을 실시하였다(유의수준: 양측 0.05 및 0.01).
단회 경피투여 독성시험의 통계처리는 단회 경구투여 독성시험의 방법과 동일하게 이루어졌으며, Folded-F 검정 법을 사용하여 등분산을 검정한 결과(유의수준: 0.05), 등 분산이 인정되어 Student t-test를 실시하여 유의성을 확인 하였다(유의수준: 양측 0.05 및 0.01).
안점막 자극시험과 피부 자극시험은 본 시험에서 얻어 진 판정치 및 측정치에 대해서는 평균을 구하고, 통계학적 해석은 실시하지 않았다.
3. 결과 및 고찰
3.1. 체중변화
단회 경구투여의 체중변화는 수컷 시험물질 3,000 및 5,000 mg/kg 투여군에서 투여 후 1과 3일에 대조군과 비교 시 유의성 있는 체중감소가 관찰되었다. 반면 관찰기간 동 안, 암컷 시험물질 투여군에서 대조군과 비교 시 유의성 있 는 체중변화는 관찰되지 않았다(Table 6). 수컷에서 관찰된 체중변화는 시험물질 투여에 기인한 것으로 판단된다.
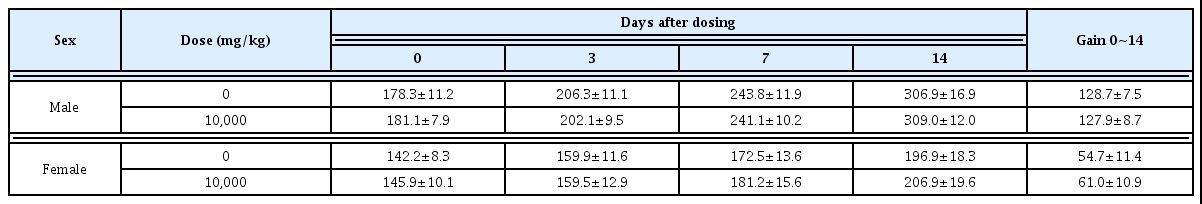
단회 경피투여 시험에서 시험군 체중은 모든 동물에서 증가하였으며, 관찰기간 동안 암수 10,000 mg/kg 투여군에 서 대조군과 비교 시 유의성 있는 체중변화는 관찰되지 않 았다(Table 7).
안점막 자극시험의 시험군 체중은 각 군의 모든 동물에 서 증가하였으며, 평균체중 증가량은 비세안군 0.21 kg, 세 안군 0.23 kg이었다. 피부 자극시험군은 0.07 kg의 평균체 중 증가량을 보였다.
3.2. 독성시험결과
3.2.1. 단회 경구 및 경피투여 독성 평가 결과
시험물질의 농도별 단회 경구투여 시험결과, 수컷 시험 군의 5,000 mg/kg 투여군에서 투여 후 6시간에 1례가 사망 하였고, 암컷 4,000 mg/kg 투여군에서 투여 후 6시간에 각 1례, 3,000 mg/kg 투여군에서 투여 후 1일에 2례, 5,000 mg/kg 투여군에서 투여 후 1일에 2례 및 투여 후 3일에 1례 가 사망하였다(Table 8). 최대 독성용량을 설정하기 위하여 예비실험에서 사망한 개체가 관찰된 투여용량을 포함하여 실험하였으나 예비실험의 결과와 동일하게 암컷 4,000 mg/kg 투여군과 3,000 mg/kg 투여군에서 사망개체가 발생 하였다. 단회 경피 투여 시험에서는 암수 대조군 및 10,000 mg/kg 투여군에서 사망례는 관찰되지 않았다(Table 9).
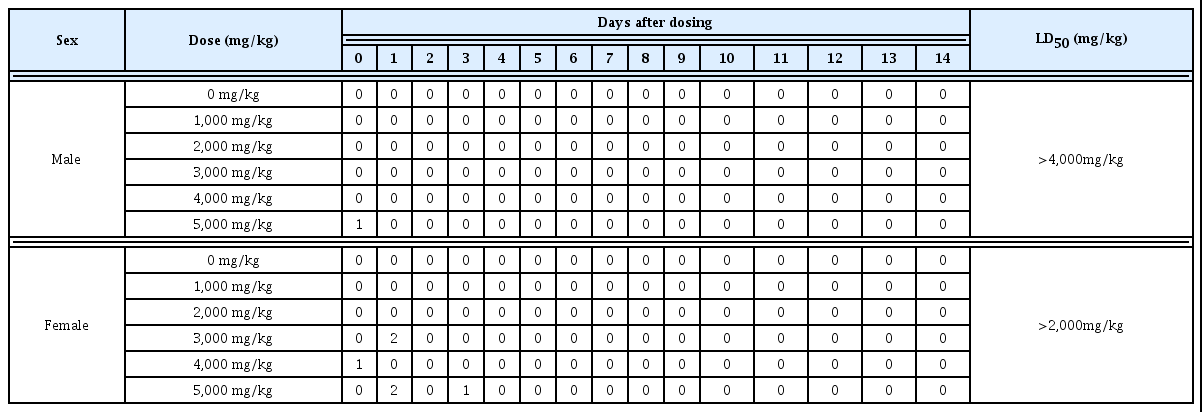
Mortality and LD50 values in male and female rats after single oral administration of Asarum sieboldii extract
단회 경구투여 시험의 시험 대조군과 암수 1,000 mg/kg 투여군에서는 이상소견이 관찰되지 않았고, 2,000 mg/kg 투여군에서 투여당일 수컷에서 2례, 암컷에서 1례에 불규 칙적인 호흡이 관찰되었으나, 투여 후 1일 이후부터 이상 증상은 관찰되지 않았다. 사망례가 관찰되지 않은 수컷 3,000 mg/kg과 4,000 mg/kg에서 투여 후 6시간에 불규칙 적인 호흡이 각 1례가 관찰되었으나, 1일 이후부터 정상적 인 행동을 나타내었다. 사망례가 관찰된 수컷 5,000 mg/kg 투여군과 암컷 3,000 mg/kg, 5,000 mg/kg 투여군에서 투여 당일 불규칙 호흡, 눈물분비, 침흘림 및 자발적 운동 저하 가 관찰되었으며, 투여 후 1일에 사료섭취량 감소, 변량 감 소, 하복부 오염과 입주위 오염이 관찰된 개체가 사망하였 다(Table 10).
단회 경피투여 시험의 관찰기간 동안, 암수 대조군 및 10,000 mg/kg 투여군에서 사망례는 없었으며, 암수 대조군 및 10,000 mg/kg 투여군에서 일반증상의 이상은 관찰되지 않았다. 부검에서도 암수 대조군 및 10,000 mg/kg 투여군 에서 육안적 이상 소견은 관찰되지 않았다.
단회 경구 및 경피 투여는 시험물질의 극단적인 독성범 위를 평가하기 위한 것으로 살생물제의 유효농도보다 높게 설정하여 평가한다. 본 시험에 사용된 족두리풀 추출물의 흰개미 살충활성을 나타내는 유효농도는 4 mg/mL로 매우 낮은 농도에서 활성을 나타내며, 경구투여 독성평가에서 암컷과 수컷의 치사량이 2,000 mg/kg과 4,000 mg/kg 이상 으로 이는 유효농도의 500배와 1000배에 해당한다. 또한 경피투여 독성평가의 경우 10,000 mg/kg에서도 사망례는 없었으며, 암수 모두에서 임상증상 및 부검소견도 특이적 인 이상 소견이 관찰되지 않았다. 따라서 본 시험에 사용된 족두리풀 추출물은 독성이 매우 낮은 안전한 물질임을 확 인하였다.
3.2.2. 안점막 자극 시험의 안구병변 및 안자극성 평가 결과
안점막 자극 시험의 안구병변 관찰 결과, 비세안군과 세 안군 모두에서 시험물질 원액투여 1, 2, 3, 4 및 7일에 각막, 홍채 및 결막 등의 안구병변은 6마리 모두에서 관찰되지 않았다(Table 11). 평균안점막자극지수(M.I.O.I.)는 각각 ‘0’ 이었다. 또한 투여 후 24시간에 플루오레세인 시험지를 이 용하여 각막이상을 검사한 결과, 6마리 모두에서 각막은 플루오레세인에 염색되지 않았고, 각막 손상도 관찰되지 않았다. 무처치 대조안에서는 모든 관찰기간에 각막, 홍채 및 결막 등의 안구병변은 모든 동물에서 관찰되지 않았다. 비세안군과 세안군의 급성안점막자극지수(I.A.O.I.)는 ‘0’ 이었다(Table 12).
시험물질의 안자극성을 ‘Guillot의 안점막자극 평가표 (Guillot, 1982)’를 참조해서 분류하면, 급성안점막자극지 수(I.A.O.I.)는 ‘0’ 으로, ‘무자극물’로 판정되었다.
3.2.3. 피부 자극 시험의 피부 반응 및 피부 자극성 평가 결과
피부 자극 시험의 자극성 평가 결과, 시험물질 원액투여 부위의 비찰과 및 찰과 부위에서 투여 후 24시간에 평점 2 의 홍반이 6마리 모두에서 관찰되었다(평균점수: 4.0). 투 여 후 48시간 및 72시간에 평점 1의 홍반이 6마리 모두에서 관찰되어 평균점수 각각 2.0의 평가점수를 나타내었다 (Table 13). 무처치 대조부위의 비찰과 및 찰과 부위에서는 24, 48 및 72시간에 홍반 및 부종 등의 피부반응은 6마리 모두에서 관찰되지 않았다(평균점수: 각 0.0). 이상의 결과 로 시험물질의 1차 피부 자극성을 Draize의 피부자극정도 의 분류에 따라 분류하면, 투여 후 24시간 및 72시간의 평 균점수는 4.0과 2.0으로 1차 피부자극지수(P.I.I.)는 1.5로 약한 자극성(Slightly irritant)을 나타내는 물질로 판정되었다.
안점막자극시험과 피부자극시험은 시험물질이 노출되 었을 경우 일차적으로 나타날 수 있는 알러지 유발 가능성 을 알아보기 위한 것으로 1차 피부자극지수가 높을수록 알 러지 발생율이 높아질 수 있다. 본 시험에 사용된 물질은 안점막자극시험의 경우는 무자극물로 판정되었으나, 피부 자극시험에서 1차 피부자극지수가 1.5로 비교적 낮게 나타 나 약한 자극성을 나타내는 물질로 확인되었다. 하지만 피 부자극의 경우 어느 한 개체라도 반응의 강도에 관계없이 양성반응이 나타나면 그 물질은 알러지 유발능을 가지고 있는 것으로 피부가 예민한 사람의 경우 피부자극을 나타 낼 수 있어 주의가 요구된다.
4. 결 론
본 연구는 천연 살생물제로 개발된 족두리풀 추출물의 안전성을 확인하고자 쥐와 토끼를 이용하여 경구독성, 경 피독성, 피부자극성 및 안점막자극성 시험을 실시하였으며 그 결과는 다음과 같다(Table 14).
쥐를 이용한 단회 경구투여 독성시험 결과, 사망례가 관 찰된 고용량 투여군을 제외하면 수컷의 최대용량은 4,000 mg/kg 투여군이며, 암컷의 경우는 2,000 mg/kg 투여군으 로 나타났다. 해당 투여군의 부검결과 특이적인 이상소견 이 관찰되지 않았으며, 투여 당일 불규칙한 호흡이 발생하 였으나 이후 안정적인 상태로 관찰되었다. 단회 경피투여 시험 결과, 10,000 mg/kg 투여군에서 사망한 개체가 없었 으며, 일반증상과 부검시 이상 소견이 관찰되지 않았다. 토 끼를 이용한 피부자극성 및 안점막자극성 시험 결과, 시험 물질 투여 후 24시간과 72시간에 홍반이 관찰되어 1차 피 부자극지수(P.I.I.)가 1.5로 약한 자극성을 나타내는 물질로 판정되었으며, 눈에 대한 자극지수는 각막, 홍채 및 결막 등의 안구병변이 관찰되지 않아 무자극물로 판정되었다.
이전 연구 사례에서 lemongrass oil을 포함한 정유를 쥐 에 경구 투여한 결과 LD50 값이 3,000 mg/kg까지는 독성이 나타나지 않았지만, 3,500 mg/kg 이상에서는 쥐의 위장이 나 간에서 형태학적 변화를 관찰하였다는 보고가 있다 (Fandohan et al., 2008). 또한, 모기 기피 효과가 있는 Neem tree의 추출물과 pyrethrin의 LD50 값이 2,000 mg/kg과 12,000 mg/kg 이상으로 안전한 물질로 각각 보고하였으며 (Singh et al., 2012), 흰개미 기피 효과가 있는 citronella와 lemongrass oil의 안전성을 입증하고자 쥐에서 단회 경구투 여 독성시험 결과 LD50 값이 2,000 mg/kg 이상으로 안전한 물질로 보고된 바 있다(Park et al., 2015). 본 시험에서도 족 두리풀 추출물의 LD50값이 수컷과 암컷에서 4,000 mg/kg 과 2,000 mg/kg 이상으로 안전한 물질로 확인되었으며, 안 점막자극성 시험은 무자극물로, 1차 피부자극지수가 1.5로 약한 자극성 물질로 판단되어 천연 살생물제로서 안전한 것으로 나타났다. 천연 살생물제의 경우 직접적인 독성뿐 만 아니라 간접적인 잔효독성도 강하게 나타나는 경우가 있으므로 식물추출물을 기반으로 하는 경우 화학농약과 같 이 급성 경구독성 및 경피독성에 대한 안전성 평가뿐만 아 니라 피부자극성과 안점막자극성 그리고 가습기 살균제 피 해 사례에서 호흡기로 인한 사망이 발생한 만큼 호흡기계 에 미치는 영향 평가도 이루어져야 할 것으로 판단된다.
사 사
본 연구는 문화재청 국립문화재연구소 문화유산 조사연 구(R&D) 사업의 지원을 받아 수행되었습니다.