국내 서식 흰개미의 개체 및 군체 식별을 위한 Nile Blue A 염색법 적용성 평가
Applicability Evaluation of Nile Blue A Dye to Korean Termite (Reticulitermes speratus kyushuensis)
Article information
Abstract
이 연구는 국외에서 지중흰개미의 생태와 방제 연구를 위해 사용하는 Nile Blue A 염색약이 국내 전역에 서식하는 R. s. kyushuensis에 대한 적용 여부 및 적정 조건을 평가하기 위해 수행되었다. 0.05%, 0.10%, 0.25%(w/w) 농도로 여과지를 염색한 뒤 1, 3, 7일간 no-choice feeding test로 염색 여과지를 강제 섭식시켜 공시충을 염색시킨 뒤 4주 동안 생존률, 염색률, 염색의 유지 여부 등을 관찰하였다. 그 결과 공시충의 생존률은 약제의 농도가 낮을수록, 약제의 섭식기간이 짧을수록 높은 경향을 보였으며 반대로 염색률 및 선명도는 약제의 농도가 높고 약제의 섭식기간이 길수록 높게 나타나 반비례하는 양상을 보였다. 다양한 농도와 섭식기간 조건 중 0.05%에서 3일, 0.10% 농도에서 3일간 염색하였을 때 높은 생존률과 염색률, 염색의 유지기간을 동시에 만족시켜 적합한 조건으로 확인되었다. 본 실험 결과는 향후 실내 실험 단계의 흰개미 관련 연구에서 약제의 섭식 여부 확인 등에 활용할 수 있을 것으로 기대된다.
Trans Abstract
Dye markers are used in the study of subterranean termites to determine colony territories and population sizes. Dyes not only allow the study of termite biology, but can also be used for control purposes. Although Reticulitermes speratus kyushuensis causes damage to wooden historical properties in Korea, the dye markers have not been applied. Therefore, we evaluated the applicability of Nile Blue A dye for R. s. kyushuensis. Filter papers dyed with concentrations of 0.05%, 0.10%, and 0.25% (w/w) were each fed to termite populations through a no-choice feeding test for 1, 3, or 7 days. After 4 weeks, the survival rate, dyeing rate, and maintenance of dyeing were recorded. The results showed high survival rates with lower dye concentrations and shorter feeding periods. Among the combinations of concentrations and days, high survival rates, dyeing rates, and dyeing maintenance periods were found at concentrations of 0.05% and 0.10% for 3 days of feeding. These maximized the survivorship and visibility. The results from the current study can be applied to investigate the ecology and control of R. s. kyushuensis in both the laboratory and field.
1. 서 론
흰개미는 온대와 아열대, 열대 지방을 중심으로 분포하는 사회성 곤충의 일종으로, 현재 약 3,106종이 분포하는 것으로 알려져 있다(Krishna et al. 2013). 흰개미는 목재 등 각종 식물성 재료를 분해하여 영양원으로 삼기 때문에 목조건축물과 농작물 등을 손상시켜 막대한 피해를 입힌다. 흰개미로 인한 경제적 피해와 방제 비용 등은 2010년 미국에서만 약 400억 달러에 달한다고 알려져 있다(Rust and Su, 2012). 국내에서는 목조문화재의 주요 손상원인 중 하나이며, 현재 국내에는 일본흰개미(Reticulitermes speratus kyushuensis)가 전국적으로 분포하며 최근 전북 등 일부 지역에서 칸몬흰개미(Reticulitermes kanmonensis)의 서식이 보고된 바 있다(Lee et al., 2015).
목조건축물의 흰개미 피해는 대부분 지중흰개미에 의해 발생하기 때문에, 지중흰개미의 생태적 특성이나 방제와 관련하여 다양한 연구가 수행되어 왔다. 이 때 각기 다른 흰개미 개체와 군체를 구별할 수 있어야 하지만 육안으로는 구별이 어렵다. 이에 흰개미 군체 또는 개체의 구별을 위해 염색약과 DNA 마커, 방사성 동위원소, 흰개미 표피의 탄화수소분석(Forschler, 1994) 등이 사용되어 왔다. 이 중 염색약은 처리 후 육안으로 염색된 대상의 가능하고 빠른 시간 내 다수의 흰개미에 적용할 수 있는 장점이 있다(Evans, 1997).
염색약은 약제의 제형에 따라 분무형과 섭식형이 있으며, 분무식 염색약은 흰개미 표피에 약제가 부착되므로 흰개미를 분리하여 염색약을 섭식하는 별도의 기간 없이 바로 적용할 수 있다(Forschler, 1994). 그러나 흰개미의 생태적 특징 중 하나인 개체 간 핥기(social grooming)를 통해 표피에 부착된 염색약이 제거되기도 하고, 각 개체가 탈피할 때 기존에 염색된 외골격이 제거되므로 염색이 오래 유지되기 어렵다. 반면에 섭식형 염색약은 흰개미가 먹은 먹이에 포함되어 소화과정에서 체내 지방에 축적되는데 염색약의 섭식량이 개체마다 다르기 때문에 색이 불균질하고, 염색의 유지기간 또한 개체별로 일부 다를 수 있다(Curtis and Waller, 1997). 그러나 염색약이 흰개미 체내 조직에 잔존하기 때문에 분무형의 단점이 나타나지 않고, 염색이 오래 유지되면서도 다른 개체들에게 전달되지 않는 장점이 있다(Evans, 1997).
이에 외국에서는 다양한 흰개미 종을 대상으로 Nile Blue A, Neutral Red, Sudan Red, Fast green, Gouache, colored glue 등 여러 염색약의 적용성이 평가되어 왔으며, 그 결과 흰개미 종마다 차이가 있으나 Nile Blue A, Sudan Red, Neutral Red 등이 유용한 것으로 보고되었다(Atkinson, 2000; Atkinson et al., 2004; Evans, 1997; Evans, 2000; Guilhermes et al., 2005; Loreto et al., 2009; Oi and Su, 1994; Su et al., 1983a; Su et al., 1983b; Su et al., 1988; Su et al., 1991). 이번 연구에서는 섭식형 염색약 중 다양한 지중흰개미 군체 서식 범위와 개체 수 연구(Evans et al., 1998; Evans et al., 1999; Su et al., 1988)에 적용된 Nile Blue A 염색약이 국내 서식 흰개미의 개체 및 군체 식별에 적용할 수 있을지 평가하고자 하였다.
2. 재료 및 방법
2.1. 연구재료
2.1.1. 염색약
본 연구에서 사용된 염색약은 Nile Blue A(N0766, Sigma Aldrich Co., USA)이며 증류수에 혼합하여 사용하였다. 선행연구(Su et al., 1991)를 참조하여 Nile Blue A 염색약과 정량 여과지(Advantec Co., JPN)의 중량비가 0.05%, 0.10%, 0.25%가 되도록 제작하여 실험에 사용하였다.
2.1.2. 공시충
공시충은 국내 전역에 서식하며 목조문화재를 손상시키는 일본흰개미(Reticulitermes speratus kyushuensis)로 충북 충주시 칠금동 탄금대 인근 야산(북위 36.9도, 동경 127.9도)에서 채집하였다. 흰개미 군체가 서식 중인 벌목된 목재를 채집하여 암실에서 보관하다가 평가 전 해체하여 공시충을 분리하였다.
2.1.3. 실험용기
양 옆이 개방된 원형 아크릴 용기(직경 80 mm*높이 60 mm*두께 5 mm)의 한쪽 끝을 치과용 석고(New hi stone, Yoshino Co., JPN)로 높이 5 mm의 바닥을 만들어(석고 4 g 당 증류수 1 ml 혼합) 실험용기로 사용하였다.
2.2. 연구방법
평가방법은 일본목재보존협회(JWPA, Japan Wood Protection Associate)의 표준시험법에 따라 강제 섭식 시험(no-choice feeding test)을 실시하였으며 평가 조건은 아래의 Table 1과 같다. 직사각형의 플라스틱 용기에 탈지면을 깔고 증류수를 분무한 뒤 실험용기의 석고로 막힌 면을 바닥으로 두었다. 탈지면에서 석고 바닥으로 유입되는 수분으로 인해 수용성인 염색액이 여과지에서 용출되지 않도록 플라스틱 망을 실험용기 위에 두고 망 위에 염색된 여과지 5기를 두었다(Figure 1). 이후 각 실험용기마다 공시충을 투입하여 염색된 여과지를 섭식하게 하였다.
염색 여과지의 섭식이 종료된 후 무염색 여과지로 교체하고 이후 4주 동안 공시충들의 사충율, 염색된 공시충의 개체수를 매주 확인하고 죽은 공시충의 사체는 제거하였다. 실험 용기는 암실에서 22 ± 2℃의 온도와 90 ± 5%의 상대습도 조건에 두었으며 실험은 총 5회 반복되었다.
3. 결과 및 고찰
3.1. 섭식 독성 평가
약제 섭식 기간과 농도에 따라 공시충의 생존율이 다르게 나타났다(Table 2). 1일 섭식 실험군은 3가지 농도 조건 모두 약제 섭식 후 생존율이 무처리 대조군과 유사하게 나타났으며, 이후 4주 동안 생존율 또한 대조군과 유사하게 나타났다. 또한 약제 농도별 차이도 나타나지 않았다.
3일 섭식 실험군의 약제 섭식 직후 생존율은 무처리 대조군과 유사하게 나타났으며 이후 기간이 경과함에 따라 대조군보다 10% 내외의 낮은 생존율이 확인되었으나, 최종 생존율은 50% 이상으로 낮지 않게 나타났다. 1일 섭식 실험군이 약제 농도별 차이가 나타나지 않은 것에 비해 3일 섭식 실험군에서는 저농도(0.05%, 0.10%)보다 고농도(0.25%) 조건에서 약 10%, 대조군에 비해 20% 내외의 낮은 생존율을 보여 농도별 차이가 확인되었다.
7일 섭식 실험군은 약제 섭식 후 이미 공시충의 40% 내외가 사멸하였으며 2주 경과 후에는 모든 공시충이 사멸하여 독성이 나타남을 확인하였다.
3.2. 염색율 및 유지기간
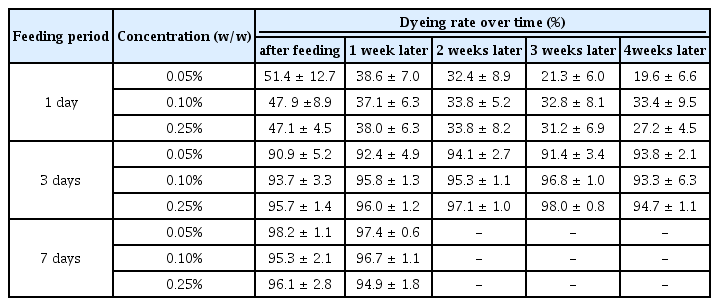
살아있는 공시충 중 육안으로 체색 변화가 확인되는 공시충의 비율을 평가한 결과는 아래의 Table 3과 같다. 1일 섭식 실험군은 염색약 섭식 종료 후 염색된 개체수가 47∼51%로 약 절반 수준이었으며, 이후 시간 경과에 따라 염색된 개체들의 숫자도 점차 감소하여 4주 후에는 20∼30%대로 점차 감소하였다. 최초 염색 시에는 농도별 차이가 확연히 나타나지 않았지만 기간 경과에 따라 저농도(0.05%) 조건에서 염색율 감소가 고농도(0.25%)에 비해 확연히 나타났다. 또한 염색된 공시충들의 체색 변화는 복부에서만 확인되며 염색도 또한 후술할 3일, 7일 섭식 실험군에 비해 연하게 나타나 기간이 경과하면서 육안으로 확인이 어려운 개체들도 나타났다(Figure 2a).

Termites workers after 1 day dyeing in 0.10% concentration (left), 3 days dyeing in 0.10% concentration (right).
반면에 3일 섭식 실험군은 약제 섭식 직후 염색된 개체수가 90% 이상으로 거의 대부분의 공시충이 염색되었으며, 이후 시간이 경과하여도 염색된 상태가 잘 유지되었다. 또한 농도별 차이도 확인되지 않았다. 공시충들의 체색 변화는 복부와 가슴 부분까지 확인되었으며 염색도가 높아 육안으로 확연히 구별되었다(Figure 2b).
7일 섭식 실험군은 염색된 개체수가 95% 이상으로 매우 높고 1주 후에도 염색이 유지되었으나, 2주 이상 생존한 공시충이 확인되지 않았다. 섭식한 염색약의 양이 가장 많아 머리를 포함한 몸 전체가 육안으로 확인이 가능할 만큼 염색되었다(Figure 3).
한편 공시충 중 염색약을 직접 섭식하지 않고 일흰개미를 통해 전달받는 병정흰개미의 염색 여부를 확인한 결과, 복부가 육안으로 확인 가능할 만큼 염색되었다(Figure 4). 이를 통해 염색약이 계속해서 섭식되는 조건이라면 직접 섭식하지 않는 개체라도 영양교환(Trophallaxis) 등을 통해 염색될 수 있음을 확인하였다.
3.3. 종합결과 및 고찰
독성과 염색율 평가 결과 1일 섭식 실험군들은 생존율이 대조군과 유사하나 염색율이 낮고 염색도 오래 유지되지 않았다. 3일 동안 0.05%, 0.10% 염색약을 섭식한 공시충들은 2주 후 약 80%, 4주 후 약 60% 이상의 0.25% 조건보다 높은 생존율을 보이며, 생존한 공시충의 염색율이 높고 염색이 오래 유지되는 양상을 보였다. 7일 섭식 실험군은 공시충들이 모두 2주 내 사멸하였다.
Nile Blue A의 대만흰개미(C. formosanus)와 동부지중흰개미(R. flavipes)에 대한 선행 연구(Su et al., 1991) 결과, 대만흰개미에서는 0.05⋅0.25⋅0.50%로 3⋅6일 섭식 후 모든 조건에서 낮은 사충율과 높은 염색율을 보였다. 특히 3일 섭식⋅0.05% 조건에서 15일이 경과할 때까지 높은 염색율을 유지하면서 대부분의 공시충이 생존하여 가장 좋은 결과를 보였으며, 3일 섭식⋅0.25%, 3일 섭식⋅ 0.50% 조건에서는 9일 이후 일부 사충이 나타나기 시작하여 본 실험 결과와 유사한 결과를 보였다. 반면 동부지중흰개미는 3일 섭식⋅0.05%, 3일 섭식⋅0.25% 조건에서는 높은 염색율과 낮은 사충율이 나타나지만 그 외 모든 조건에서 높은 사충율이 나타났다(Su et al., 1991). 본 연구의 시험 대상인 일본흰개미 아종과 대만흰개미의 실험 결과는 유사하였으나 동부흰개미의 경우 동일한 염색약이라도 종마다 감수성의 차이가 나타나는 것을 확인할 수 있다.
흰개미 염색약으로 사용되기 위해서는 흰개미의 생존에 영향을 주지 않으면서 육안으로 염색 여부를 확연히 구별할 수 있어야 하며, 염색의 유지 기간이 수 주 이상 유지되어야 한다(Evans, 1997; Atkinson, 2000). 특히 야외 흰개미 군체의 개체수 추정을 위해 사용되는 표지-방사재포획 방법(Mark-release-recapture method)에 염색약이 사용되는데(Thorne et al., 1996), 이 때 정확한 군체의 개체수 추정을 위해서는 염색약을 섭식한 개체들이 모두 염색되어야 하고, 채집된 염색이 최소 3주 이상은 유지될 필요가 있다(Su and Scheffrahn, 1988). 따라서 본 실험 결과에서 나타난 생존율과 염색의 유지기간 등을 종합적으로 고려할 때, 강제 섭식 상황인 경우 R. s. kyushuensis 에는 3일 섭식, 0.05%∼0.10% 농도 조건이 적합하였다. 이번 실험에서는 실제 지중흰개미들의 생활 환경과는 다르게 제한된 공간에서 대기에 노출된 상태로 유지되었으므로, 생존에 다소 불리한 조건이다. 실제 현장 적용 시에는 염색 후 원래 서식처로 돌려보내기 때문에 본 실험 조건보다 흰개미의 생존에 유리할 것으로 추정되며, 염색약을 섭식한 흰개미들의 생존율 또한 더 높을 것으로 추정된다.
4. 결 론
지중흰개미의 생태와 방제 연구에 있어 각 군체나 개체를 구별하는 것은 필수적이다. 본 연구에서는 다양한 지중흰개미를 대상으로 군체 판별 등을 위해 사용되어온 Nile Blue A 염색약의 국내 서식 흰개미 R. s. kyushuensis에 대한 적용성을 평가하기 위해 섭식독성, 염색율, 염색 유지기간, 타 개체 전달성 등을 평가하였다. 그 결과 0.05%, 0.10% 농도에서 3일간 섭식할 경우 흰개미의 생존율과 염색된 비율이 둘 다 높으면서 염색의 유지기간 또한 4주 간 유지되어 적합한 조건인 것으로 산정되었다. 또한 염색약을 직접 섭식하지 않고도 영양교환 등을 통해 염색될 수 있음을 확인하였다. 이 결과는 흰개미의 생태 및 방제와 관련된 실내 실험 시 특정 물질의 섭식 여부 등을 확인하는데 활용될 수 있을 것으로 기대된다.
Acknowledgements
본 연구는 문화재청 국립문화재연구소 안전방재연구실에서 수행중인 ‘건조물문화재 안전관리 조사연구’ 과제의 일환으로 수행되었습니다.