소가죽부위 및 추출조건에 따른 전통 아교 특성 변화
Properties Change of Korean Traditional Animal Glue Depending on The Parts of Cattle Hide and Extraction Conditions
Article information
Abstract
본 연구에서는 전통방식으로 재현한 아교를 대상으로 가죽부위에 따른 다양한 추출조건별 특성변화를 확인하고자 하였다. 평균분자량(Mw, Mz)은 추출시간에 따라 증가하였으며, 다분산성(PDI)은 추출시간에 따라 증가하다 추출 48시간에서 감소하였다. 평균분자량과 PDI 모두 가죽부위별 차이는 없었지만, 개체별로는 총분자량 차이가 있었다. 추출물의 차이는 아교(젤라틴)를 대표하는 Amide 영역들을 통해 비교한 결과, 추출시간에 따라 뱃가죽의 삼중나선구조가 파괴되는 것이 확인되어 가죽부위별 차이점이 확인되었다. 물성평가 결과, 황색도는 추출시간이 증가할수록 높아졌고, 점도는 분자량의 변화와 비례하지 않았다. pH는 화학적 전처리가 없는 생산아교의 일반적인 특징과 동일하게 나타났다. 각 추출조건에 따른 생산아교의 특징들을 전체적으로 분석한 결과, 소 개체별 차이가 큰 영향을 미쳐 소량 추출의 경우 일정한 품질을 유지하기 힘들다는 것을 확인하였다. 추후 더 다양한 추출조건에 대한 연구가 진행되어 일정한 품질을 가진 전통아교의 보급을 기대한다.
Trans Abstract
We investigated the properties of Korean traditional animal glue which are associated with the use of different parts of cattle hide and extraction conditions. Both average molecular weight(Mw, Mz) and polydispersity (PDI) of the animal glue increased with extraction time, whereas only PDI decreased after 48h. There were no differences in the average molecular weight and PDI for the different cattle hide parts used, although a individual difference was observed with regard to total molecular weight. Differences in extracts over time were compared by investigating the amide regions representing the gelatien component of the animal glue. The triple helix structure of the belly skin deteriorated in a manner proportional to the extraction time, and differences were observed for each cattle hide part. The yellowness increased with the extraction time; however, the viscosity was not proportional to the average change in molecular weight. This study has some limitations because of difficulties in the quality control of cases where small amounts of glue were extracted as small differences might impact the overall results considerably. Further research exploring various extraction conditions is required to ensure the prodiction of traditional animal glue with optimum qualities.
1. 서 론
아교(阿膠)는 동물의 가죽, 뼈 등을 오랜 시간 끓여 추출한 액체를 굳힌 것으로 우리나라에서 전통적으로 사용해온 천연 동물성 접착제이다. 아교 사용과 관련된 가장 오래된 기록은 일본서기에서 찾아볼 수 있는데, 610년(영양왕 21) 고구려 승려 담징(曇徵)이 일본에 종이와 먹 등의 제조방법을 전한 기록이 있다. 먹을 만들 때 아교가 필요했기 때문에 삼국시대부터 아교를 제조 및 사용했다고 유추할 수 있다(Lee et al., 2019). 그 이후의 기록 중에는 조선시대의 경국대전, 조선왕조실록에 아교 장인에 대한 내용과 아교 제조 및 사용처에 대한 내용이 있으며, 조선 후기의 산림경제, 오주서고종박물고변에는 소가죽을 원료로 하는 아교 제조 방법이 기록되어 있다(National Science Museum, 2009). 그러나 일제강점기를 지나면서 전통아교의 맥이 끊기고, 1970, 1980년대에는 사용이 편리한 합성접착제에 밀려 전통아교는 국내에 거의 사라져 현재는 대부분 수입 아교를 사용하고 있는 실정이다(Lee et al., 2019).
문화재 보존분야에서 사용되는 아교는 그 쓰임새가 매우 다양하다. 가장 많이 사용되는 곳은 서화 또는 단청 등의 채색 문화재에 교착제로 사용되고 목재나 지류를 재료로 하는 공예활동의 접착제로도 사용되고 있다. 실제 국내 보존처리 현장에서 가장 많이 사용되는 아교는 단일 동물의 가죽을 원료로 한 제품이며, 주로 소가죽을 원료로 하는 일본산 아교이다(Oh et al., 2019).
소의 생가죽은 64%의 수분과 33%의 단백질로 이루어져 있으며, 단백질 중 87%는 콜라겐이 차지하고 있다(Shin, 2012). 콜라겐은 구조 단백질로서 일반 단백질에 비해 분자량이 매우 크며, 콜라겐분자 1개의 분자량은 약 30만이다. 또한, 콜라겐의 세부 구조는 폴리펩티드 사슬이 삼중나선모양으로 꼬인 형태이며, 각각의 폴리펩티드 사슬들의 대다수는 ‘글리신(Glycine)-X-Y’의 반복적인 아미노산 배열로 이루어져 있다(Shin, 2012). 우리가 사용하는 아교는 이러한 콜라겐을 열수 추출하여 만든 변성 단백질(젤라틴)을 의미한다. 따라서 추출된 아교(젤라틴)의 구조적, 이화학적 특성은 모두 원료, 전처리 과정, 추출 온도 및 시간 등의 추출조건에 영향을 받는다.
다양한 조건에 따른 콜라겐 추출 및 평가에 대한 연구는 주로 식품 및 공업 분야에서 활발하게 이루어져왔다. 전처리 공정에 따른 추출 젤라틴의 특성 연구(Yeom et al., 2004; Mad‐Ali et al., 2016), 다양한 원료에서 추출한 콜라겐의 구조변화 및 물성변화를 규명한 연구(Yoo, 2009; Yang and Hong, 2012), 분자량 분포 또는 아미노산 함량이 추출된 젤라틴의 물성에 어떤 영향을 미치는지에 대한 연구(Haug et al., 2004;Lim et al., 2011) 등이 이루어졌다. 반면, 전통아교에 대한 연구는 최근에서야 진행되기 시작했다. 연구 초기에는 우리나라에 전통아교를 생산하는 공장 또는 고문헌의 전통제조법을 검증해본 적이 없는 상태였기 때문에, 원료의 선정부터 전통제법을 현대식으로 검증하는 연구(National Science Museum, 2009)부터 진행되었다. 이후, 전통방법으로 복원한 아교의 다양한 쓰임에 대한 연구들이 진행되었으며 단청작업에 사용되는 아크릴에멀젼계 접착제(포리졸), 시판아교, 전통제조법으로 생산한 아교의 내후성을 비교하는 연구(Lee, 2010)와 수분반응성을 비교하는 연구(Park et al., 2013)가 대표적이다. 최근에 들어서는 시판아교에 준하는 접착력을 가지는 아교를 생산하기 위한 전통제조법을 확립한 연구(Do et al., 2019)와 문화재에 사용되는 아교의 일관적인 특성평가를 위한 전처리 및 측정조건을 제시하는 연구(Oh et al., 2019), 목공예분야에 알맞은 물성을 가진 전통아교를 개량 및 개발하는(Kim et al., 2019) 등 우리나라 아교의 전통 제법을 확립하는 것뿐 아니라 이를 활용하는 연구도 꾸준히 진행되고 있다.
그러나 전통아교에 관한 연구들이 아직 현장에는 적용되지 못하고 있다. 이는 전통아교를 사용하고 싶어도 개인이 직접 추출한 아교는 대량으로 제조하지 못할 뿐더러 물성이 일정하지 않아 사용하기 어렵고, 품질에 대한 신뢰도가 있는 전통 아교 시제품이 생산되는 것도 아니기 때문이다. 이를 해결하기 위해서는 생산자가 추출조건에 따라서 전통아교의 물성을 예측할 수 있어야 하며, 세부적인 추출조건에 따른 아교의 물성 변화를 다각도로 분석하는 연구가 선행되어야 한다. 따라서 본 연구에서는 국내 소가죽을 대상으로 전통제법으로 아교를 생산하고 추출조건에 따른 구조변화와 분자량 및 물성 변화를 함께 비교하고자 하였다.
2. 연구 방법
2.1. 전통 아교 제조
2.1.1. 원료 선정 및 전처리 과정
산림경제, 오주서고종박물고변에 기록된 전통아교의 제법을 토대로 본 연구의 원료는 소가죽으로 정하였다. 소의 종류와 산지 등에 의한 오차를 줄이기 위해서, 피혁 가공업체에서 태어난 지 약 3년 된 황소(전라도 지역)를 선별하여 수급하였다. 가죽은 육안으로 두께, 색상, 경직도 등을 확인하여 동일한 것을 선정하였다. 가죽의 전처리 상태는 염장된 것으로 통일하였으며, 약품처리는 하지 않은 것으로 선정하여 그로 인한 영향이 없도록 하였다.
추출된 아교에 대한 소 개체별 차이를 확인하기 위해서 서로 다른 2마리의 소가죽을 선정하였다. 선정된 소가 죽은 물리적으로 지방층을 제거하고, 염분 농도가 0.3% 이하가 되도록 수회 반복 세척하였다. 가죽부위별 차이를 보기 위해서 등가죽과 뱃가죽으로 분류하여 10 × 80 mm의 크기로 재단하였으며(Figure 1A), 추출 실험의 재현성을 위하여 각 가죽부위는 3배수로 준비하였다. 시료명은 소의 종류와 가죽부위, 추출시간에 따라 명명하였다(Table 1).

Extraction from cattle hide glue. (A) Cut cattle hide, (B) Boiling cattle hide in a constant-temperature water bath, (C) Extraction complete.
2.1.2. 아교 추출
화학적 처리를 거치지 않은 소의 생가죽은 낮은 온도에서 아교의 추출 수율이 매우 낮고, 고온에서도 장시간의 추출 시간이 요구된다. 동일종, 동일성별, 동일연령대의 소일지라도 개체에 따라 차이가 많으나, 자체 실험을 통해 현실적으로 유의미한 추출수율을 얻기 위해서는 80℃ 이상의 고온에서 20시간 이상 가열하는 것이 필요함을 알 수 있었다(미발표). 그러나 보다 높은 추출효율과 생산품의 품질관리를 위해서는 80℃, 20시간 추출 조건에서의 콜라겐 분해량, 아교 추출량, 가열시간에 따른 물성 변화 그리고 고온에서 장시간 가열의 경우 가죽과 추출물에서 어떠한 변화가 발생되는지 확인하는 것이 필요하다. 이에 80℃에서 20시간 이상 가열하는 조건을 선정하여 해당 조건에서의 추출 후 가죽상태와 추출물을 비교하였다. 가죽은 10 × 10 cm 정도의 크기로 재단하고, 증류수와 1:2.4(w/v)의 비율로 70℃ 항온수조(BW3-20G, JeioTech, KOR)에서 약 30분간 중탕하여 불순물을 제거하였다. 불순물을 제거한 가죽에 전처리 과정과 동일한 비율의 증류수를 넣어 80℃ 항온수조에서 아교를 추출하였으며, 추출은 2회 진행하였다(Figure 1B, 1C). 먼저 28시간 동안 초탕을 진행한 뒤, 동일 가죽에 새로운 증류수를 넣어 20시간(총 48시간) 동안 재탕을 하였다(Table 2). 초탕 과정에서는 20, 24, 28시간마다, 재탕 과정에서는 8, 12시간(총 36, 48시간)마다 각각 추출된 아교수를 채취하였다. 총 5개 시간대의 아교수는 분자량을 측정하였고, 초탕(28시간)과 재탕(48시간) 아교는 건조하여 적외선분광분석 및 물성 평가의 시료로 사용하였다.
2.2. 가죽조직분석
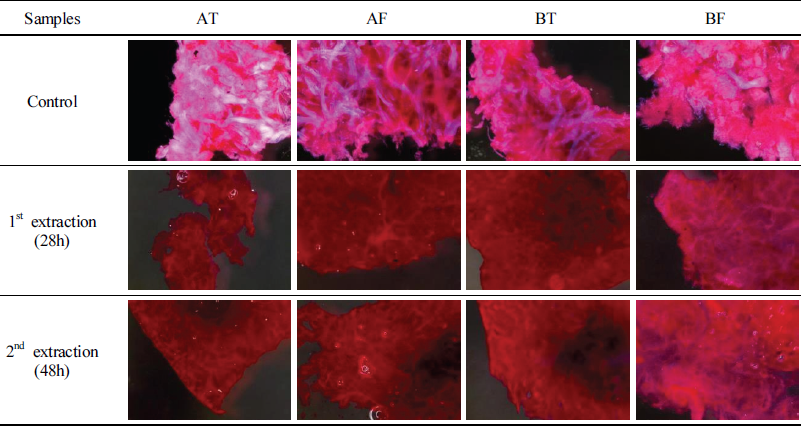
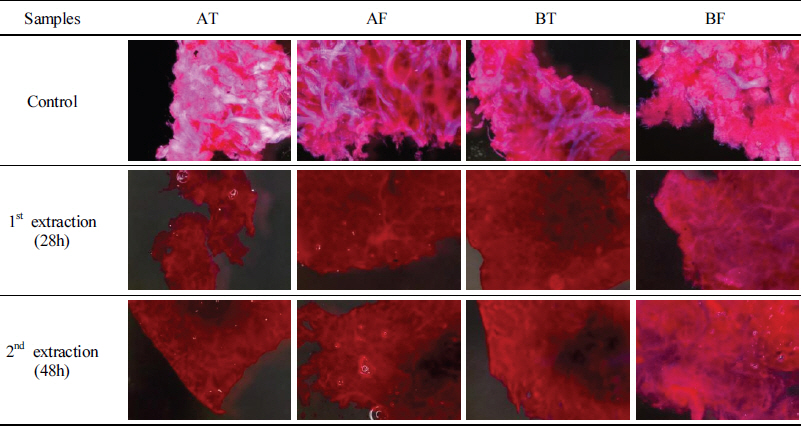
소의 개체별, 가죽부위별, 추출 시간에 따른 조직의 분해정도를 확인하기 위해 가죽조직분석을 진행하였으며, 해당 분석은 젠헤리티지에 의뢰하였다. 조직을 확인하는 방법으로는 Haematoxylin–Eosin 염색법(이하, H&E 염색법)을 사용하였다. H&E 염색법은 검푸른 색의 헤마톡실린(Haematoxylin)과 붉은색의 에오신(Eosin) 두 염료를 이용하는 방법으로 생물 시료의 조직검사 시 유용한 염색법이다. 염기성 염료인 헤마톡실린은 세포 조직에서 인산기가 많이 들어 있는 세포핵을 염색하고 산성 염료인 에오신은 세포의 안팎에 널리 분포하고 있는 단백질의 아미노기를 가진 원자단과 결합하여 염색된다.
가죽시료는 A소, B소의 등가죽, 뱃가죽 각 3배수 중 1개를 대상으로 하였으며, 초탕과 재탕이 종료된 후 일정량 시료를 채취하여 분석하였다. 면도날을 이용하여 가죽 절편을 만들어 염색하고, 실체현미경(SMZ18, Nikon, JPN)으로 조직을 관찰하였다(Table 2).
2.3. 분자량 측정
분자량과 분자량분포는 아교의 기본적인 물성에 영향을 미치는 요소이다. 따라서 추출 아교수의 분자량 변화를 확인하기 위해 GPC(Gel Permeation Chromatography)를 이용하여 분자량을 측정하였으며, 해당 분석은 ㈜한국고분자시험연구소에 의뢰하였다.
추출과정에서 채취한 시료는 GPC(EcoSEC HLC-8320, Tosoh, JPN) 기기를 이용하여 분석하였다. 컬럼은 TSKgel guard PWxl + 2 × TSKgel GMPWxl + TSKgelG 2500PWxl(7.8 × 300 mm)를 이용하였다. 시료는 200 μl 주입하였고, 용매는 0.1M NaNO3를 유속 1.0 mL/min로 설정하여 사용하였다. 분자량 분포는 온도 40℃에서 굴절률 검출기(RI-detector; Refractive Index-detector)를 사용하여 확인하였다. 표준시료는 PEG/PEO를 사용하였다(Table 2).
2.4. 적외선분광분석
소가죽에서 추출된 아교 단백질의 2차 구조변화를 확인하기 위해 적외선분광분석을 진행하였다. 콜라겐을 추출하는 과정에서 폴리펩티드 사슬은 결합력을 잃고 분해되는데, 이때 화학구조가 변하게 된다. 즉, 적외선분광분석 스펙트럼을 통하여 추출된 아교의 분해정도를 파악할 수 있다.
초탕과 재탕 아교는 각각 슬라이드글라스에 필름상으로 건조하여 감쇠전반사(ATR, Attenuated Total Reflection) 장치가 부착된 FT-IR(Alpha, Bruker Optics, GER)로 분석하였다. 조건은 4,000∼600 cm-1 범위에서 분해능 4 cm-1, 스캔 횟수 32회로 하였다(Table 2).
2.5. 물성평가
추출시간에 따른 아교의 물성변화를 확인하기 위해 초탕과 재탕 아교를 대상으로 색도, 점도, pH를 측정하였다. 측정방법은 선행연구(Oh et al., 2019)와 KS규격(KS M ISO 9665:2010, 접착제-아교-시료 채취 및 시험방법)을 참고하였다(Table 2).
색도는 농도 10%(w/v) 아교수를 분광측색계(Colormate, Scinco, KOR)로 황색도(ASTM E313-73)와 총투과율을 측정하였다. 준비된 시료는 액체 측정용 페트리디쉬에 담아 흰색 덮개를 배경으로 측정하였으며, 분석 조건은 표준광원 D65, 시야각 10°, 분석면적 ∅28 mm로 하였다.
점도는 농도 12.5%(w/v) 아교수를 회전식마찰점도계(DV2T, Brookfield, USA)로 측정하였다. 분석 조건은 측정범위 LV-01(61), spindle 회전속도 100 rpm, 측정시간은 1분으로 하였다.
pH는 농도 1%(w/v) 아교수를 온도 35±1℃로 유지하면서 pH미터기(LAQUA-PH1200, HORIBA, JPN)로 측정하였다.
3. 연구 결과
3.1. 가죽조직변화
동물 가죽은 표피와 진피로 나뉘며 진피는 모근, 땀샘, 피지선 등이 있는 유두층(乳頭層)과 콜라겐 섬유가 매우 발달한 망상층(網狀層)으로 구분할 수 있다. 추출 시간별 가죽 시료의 H&E 염색 결과, 산성염료인 에오신에 의해 세포질은 붉게, 콜라겐 섬유(아교질)는 핑크색으로 염색되었으며 헤마톡실린에 의해 청색으로 염색된 곳은 없었다. 소의 개체, 가죽부위에 관계없이 모든 시료에서 모근, 땀샘, 동맥, 정맥 등이 관찰되지 않았으며, 대조군(생가죽)에서 콜라겐 섬유가 선명하게 염색되었다(Table 3). 이는 가죽의 전처리 과정에서 표피, 털, 모근 등이 대부분 제거되었으며, 콜라겐이 풍부한 진피의 망상층을 대상으로 아교가 추출되었다는 것을 보여준다. 또한, 대조군과 비교하여 추출이 진행된 가죽들은 모두 진한 적색으로 염색되었다. 특히, 초탕과 재탕의 염색양상이 동일하게 나타났고, 콜라겐이 추출되기에는 28시간이 충분한 시간이었다는 것을 의미한다. 이를 통해 생가죽과 추출한 가죽의 차이는 확인할 수 있었지만, 개체별, 가죽부위별, 추출 시간에 따른 변화는 명확하게 확인하기 어려웠다.
3.2. 분자량 변화
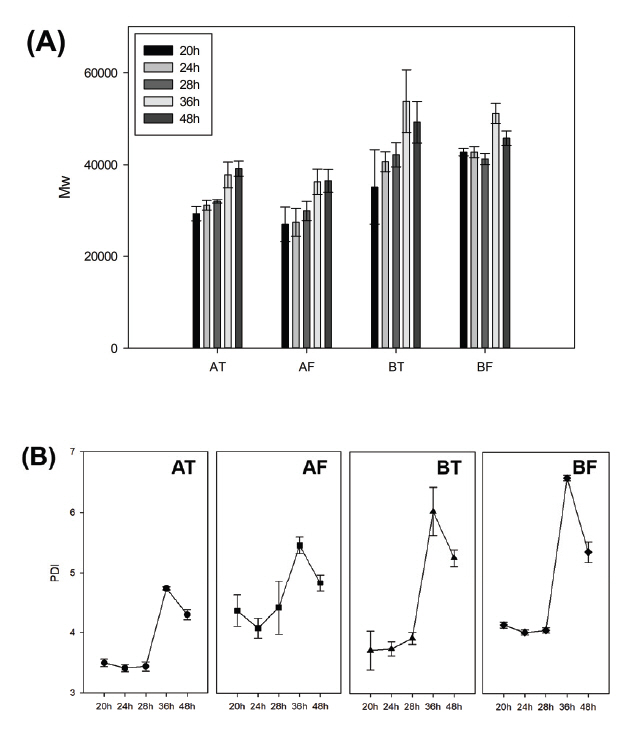
고분자의 분자량은 여러 크기의 분자들이 혼재하기 때문에 평균 분자량의 개념으로 표현해야 하며, 연속적인 분자량의 그래프로 분자량의 분포를 확인할 수 있다. 평균 분자량은 수평균분자량(Mn), 중량평균분자량(Mw), 부피평균분자량(Mz)으로 구분할 수 있으며, 일반적인 고분자의 분자량은 Mw로 확인한다. 분자량의 분포는 다분산성(PDI, Polydispersity)으로 나타낸다. 추출 시간 및 가죽 부위에 따른 평균분자량과 PDI는 Table 4에 정리하였다.
A소, B소 모두 가죽부위와 관계없이 평균적으로 추출시간에 따라 Mw와 Mz가 증가하는 경향을 보였다. 반면, Mn은 초탕이 재탕보다 추출 분자량이 더 높았으며, 28시간과 36시간의 차이가 A소는 약 6,000∼7,000, B소는 약 10,000 정도 차이 났다(Figure 2A). 그러나 총분자량은 부위별 차이가 없었으며, Mw, Mz와 동일하게 A소보다 B소에서 더 높게 측정되었다. 즉, 가죽부위는 추출시간에 따른 분자량에 큰 영향을 미치지 않지만, 각 개체별 가죽의 총분자량이 다른 것으로 보아 개체에 따른 차이가 존재한다고 사료된다. 같은 종의 소라도 나이, 성장환경, 건강상태 등 여러 가지 조건에 따라 가죽의 결합이 다양하다는 연구(Muyonga et al., 2004)가 이를 뒷받침해준다.
아교의 분자량이 같더라도 분자량 분포에 따라 물성차이가 생길 수 있으므로(Eysturskarð et al., 2009) PDI의 변화도 확인하였다. PDI는 소 개체, 가죽부위에 따른 차이점은 없었으나 추출시간에 따른 경향을 보였다(Figure 2B). 모든 시료에서 추출시간이 지날수록 PDI가 점점 증가하다가 재탕 36시간에 최댓값을 가지고, 48시간에는 감소하였다. PDI가 높다는 것은 넓은 분자량 분포를 가지고 있으며, 다양한 크기의 분자들로 이루어져있다는 뜻이다. 즉, PDI가 낮게 측정된 추출 28시간까지의 추출아교는 콜라겐이 일정한 크기로 분해되어 추출되었고, 추출 36시간 이후의 추출아교는 저분자화되지 못한 분자량이 큰 펩티드 사슬이 추출되어 다양한 크기의 분자들이 분포하게 되어 높은 PDI를 나타낸 것으로 판단된다.
3.3. 적외선분광분석
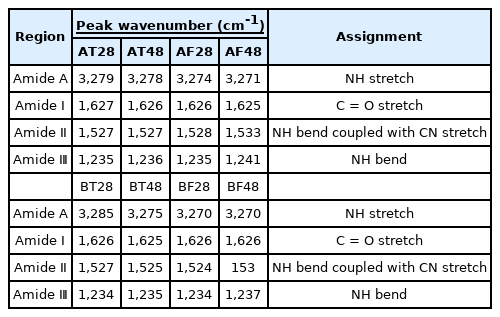
아교 추출에 따른 스펙트럼의 변화를 확인할 수 있는 주요 영역은 3,600∼3,200 cm-1 범위의 Amide A, 1,700∼1,600 cm-1 부근의 Amide Ⅰ, 1,550∼1,500 cm-1 부근의 Amide Ⅱ, 1,400∼1,200 cm-1 범위의 Amide Ⅲ 영역이다(Yang et al., 2012; Barth, 2007; National Research Institute of Cultural Heritage, 2014). 추출된 아교의 적외선분광분석 결과, 모든 시료의 스펙트럼은 유사하게 확인되었다(Table 5, Figure 3).

FT-IR spectra of extracted cattle hide glues. (A) Amide A of wavenumbers 3,600∼3,100 cm-1 (B) Amide Ⅰ, Ⅱ, Ⅲ of wavenumbers 1,700∼1,200 cm-1.
추출온도, 원료의 나이 등 조건을 다양하게 하여 젤라틴을 추출한 선행연구들의 경우, 각 조건별 스펙트럼의 차이가 분명하게 확인되었다. 대표적으로 N-H stretch와 관련된 Amide A 영역은 콜라겐의 단백질이 분해되어 방출된 자유 아미노기가 수소결합에 관여할 때 낮은 파수로 이동한다는 연구(Mad‐Ali et al., 2016)가 있으며, C = O stretch와 관련된 Amide Ⅰ 영역도 추출시간이 길어질수록 콜라겐의 펩타이드 사슬이 파괴되어 발생한 카르보닐기(Carbonyl group)가 수소결합을 하게 되어 높은 파수로 이동한다는 연구(Kittiphattanabawon et al., 2016)가 보고되었다. 또한, 콜라겐의 삼중나선구조와 관련된 Amide Ⅲ 영역의 경우, 고온에서 추출한 젤라틴은 저온 추출 젤라틴보다 삼중나선구조 파괴가 활발히 진행되어 해당 영역의 피크가 현저히 낮게 확인된 연구(Mad‐Ali et al., 2016)도 보고되었다.
전통방식으로 추출한 아교의 스펙트럼과 위의 선행연구를 비교해본 결과, Amide A 영역에 해당하는 피크들은 BF를 제외하고 모두 낮은 파수로 이동함을 확인하였다. 선행연구에서는 약 200 cm-1만큼 이동하였지만, 본 실험의 추출 아교는 1∼10 cm-1 정도만 이동하여 그 폭이 크지 않았다. Aamid Ⅰ 영역의 경우는 오히려 추출시간에 따라 낮은 파수로 이동하였다. Amide Ⅲ 영역은 추출시간에 따라 등가죽(T)과 A소의 뱃가죽(AF)은 해당 영역의 피크 높이가 달라지지 않았지만, B소의 뱃가죽(BF)은 피크가 낮아진 것이 확인되었다. 이는 BF의 경우, 재탕(48시간)에서 콜라겐의 삼중나선형 구조가 상당량 분해되었기 때문으로 판단된다.
3.4. 물성변화
초탕(28시간)과 재탕(48시간) 아교의 색도를 측정한 결과, 황색도와 총투과율은 반비례 관계로 나타났다(Figure 4A, 4B). 콜라겐을 추출하여 얻은 아교는 단백질 분해 산물, 미네랄, 지방 등의 불순물을 함유하고 있어 노란색 또는 갈색을 띠고 있다(Florian, 2007). 즉, 황색도가 높다는 의미는 추출액 속에 여러 가지 불순물이 많다는 것이므로 탁도가 높아져 총투과율이 낮아진다는 것이다. 일반적으로 지방 등의 단백질 외 다른 성분들이 많다고 생각되는 뱃가죽(F)이 등가죽(T)보다 황색도가 더 높게 측정될 것이라고 예상되지만, 가죽부위에 따른 차이는 나타나지 않았다. 추출시간에 따른 변화 양상을 보면 초탕보다 재탕의 황색도가 높았다. 이러한 결과는 아교의 추출시간이 길어질수록 아미노기(-NH2)와 카르보닐기(-COOH)가 마이야르 반응(Maillard reaction)을 일으켜 황색으로 변한다는 연구(Mad‐Ali et al., 2016)와 일치한다. 개체별 황색도를 비교해보면, A소보다 B소의 황색도가 더 높은데, 이는 분자량과 동일한 경향을 보여준다. B소는 A소보다 전체 적으로 분자량이 높게 측정되었다(Figure 2A).
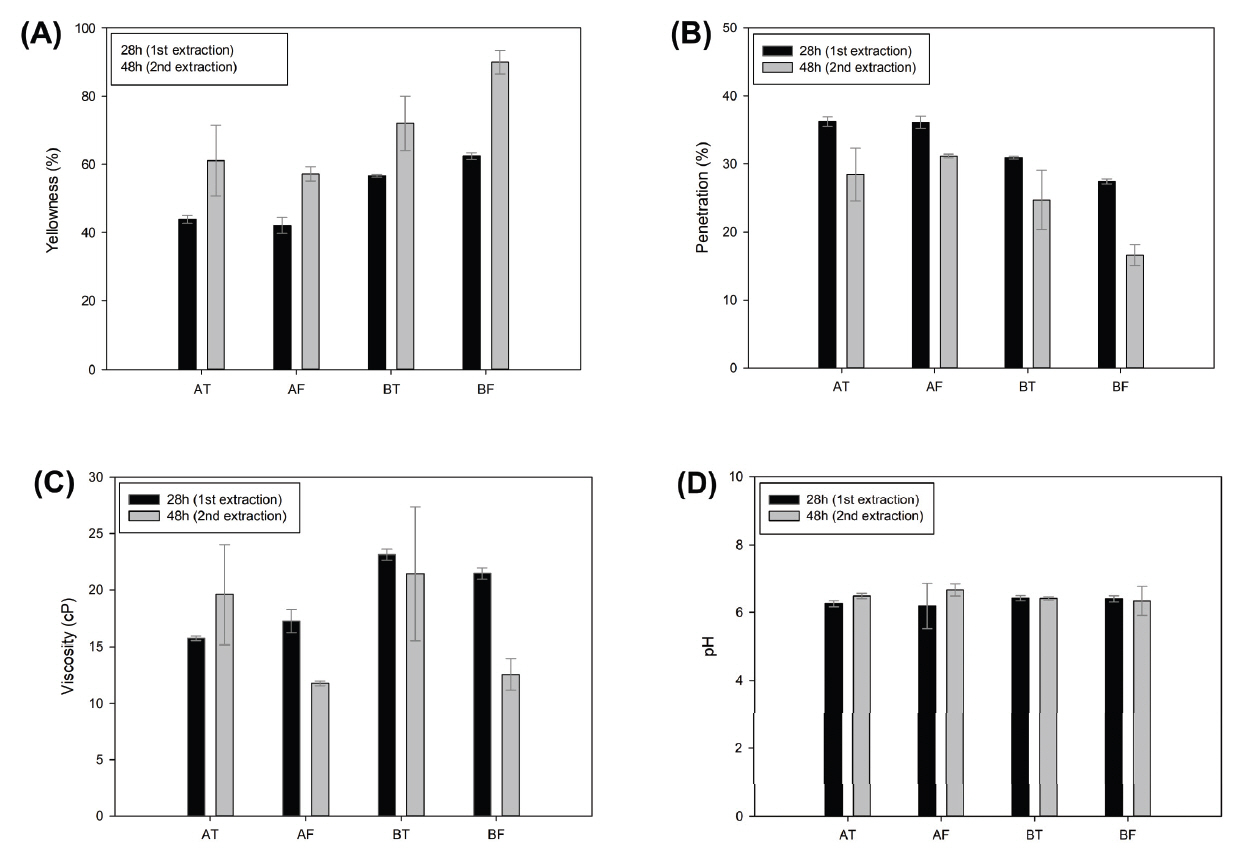
Variation in properties of extraction conditions. (A) Yellowness, (B) Penetration, (C) Viscosity, (D) pH.
점도의 경우, 평균적으로 B소가 A소보다 높게 측정되어 개체에 따른 차이가 나타났다(Table 4C). 점도는 아교의 분자량과 큰 연관이 있기 때문에 A소의 분자량이 상대적으로 B소보다 낮은 것과 동일한 경향을 보인다고 할 수 있다. 그러나 점도는 단순히 분자량과만 비례하는 것이 아니라 분자량의 분포와도 관련 있는 것으로 알려져 있다(Schellmann et al., 2009). 따라서 PDI와 점도를 비교해본 결과, 추출시간에 따라 PDI는 모든 시료에서 동일한 경향으로 증가하였으며(Figure 2B), AT만 추출시간에 따라 점도가 증가하였고 나머지 시료들은 감소하였다. PDI는 값이 높을수록 저분자부터 고분자까지 다양한 분자량의 분자가 섞여 있다는 뜻으로 결합능력이 약해질 수밖에 없어 점도가 낮아지는 경향이 있다. 이는 AT를 제외한 나머지 시료에서 재탕의 점도가 더 낮아지는 것과 관련이 있다고 사료된다.
pH의 경우, 화학적 전처리를 하지 않은 생산아교는 단백질이 분해되면서 나오는 아미노산에 의해 자연적으로 약산성을 띄게 되는데, 본 연구 결과에서도 소의 개체나 가죽부위에 관계없이 모든 시료에서 pH 6.2∼6.7로 측정되었다(Figure 4D).
4. 고찰 및 결론
우리나라에서는 전통적으로 소가죽을 이용하여 아교를 제작 및 사용해왔다. 그러나 일제강점기를 거치면서 전통제법이 사라지고, 보관 및 사용이 편리한 합성접착제에 밀려 사라지게 되었다. 최근 들어 전통아교를 복원하고 이를 활용하려는 연구가 진행되고 있지만, 소량 생산 체제에서의 품질관리 문제로 인해 실제 사용으로는 이어지고 있지 않다. 이에 본 연구는 전통아교의 생산자가 품질이 일정한 아교를 생산할 수 있기 위해 다양한 추출조건에 따른 아교 특성을 예측할 수 있도록 개체별, 가죽부위별, 추출시간별 변화를 확인하였다.
먼저, 가죽조직 분석을 통해서는 생가죽과 추출된 가죽의 구분만이 가능하였으며 추출에 따른 조직의 세부적인 분해 정도나 양상은 확인할 수 없었다. 분자량의 경우, 추출시간에 따라 평균적으로 증가하는 것을 확인하였으나 가죽부위에 따른 차이는 없었다. 다만, 개체별 차이는 확인되었는데, 이는 원료를 어떻게 선정하느냐에 따라 분자량이 달라진다는 것을 의미한다. 본 실험에서는 원료를 선정함에 있어 지역, 연령, 성별을 통일하고, 가죽의 상태 또한 육안으로 확인하여 일정한 품질의 가죽을 선정했음에도 분자량 분석에서 개체별 차이가 나타났다. 즉, 1∼2 마리의 소를 대상으로 아교를 소량추출하였을 때는 아교를 추출할 때마다 분자량이 일정하지 않을 수 있어 물성을 일정하게 유지하는 것이 어려울 것으로 판단된다. 분자량 분포를 나타내는 PDI는 개체별, 가죽부위별 차이는 없었으나, 초탕보다 재탕의 분자량 범위가 넓어진다는 경향을 확인하였다. 적외선분광분석의 경우, 일반적으로 아교(젤라틴)에서 확인되는 Amide 피크는 모두 관찰되었으나, 개체에 따른 스펙트럼의 차이는 없었다. 다만, Amide Ⅲ 영역에서 BF가 48시간 추출 후 콜라겐의 삼중나선구조가 파괴되어 피크가 낮아지는 양상을 보임으로써 가죽부위별, 부위별 차이가 있다고 판단된다. 전통제법은 화학적 전처리를 진행하지 않고 오직 가열에 의해서만 추출하기 때문에 원료의 차이가 크지 않다면 추출조건에 따른 적외선분광분석의 스펙트럼에 큰 차이가 없을 것으로 사료된다.
색도는 추출시간이 증가하면서 황색도가 높아지는 것을 확인하였다. 총투과율은 황색도와 반비례 관계로 나타났으며, 현재 우리나라에서 시판되고 있는 아교를 대상으로 색도를 평가한 Oh et al.(2019)의 결과와 동일하였다. 점도의 경우 평균분자량과 분자량 분포에 영향을 많이 받기 때문에 이에 대한 비교를 진행한 결과, AT를 제외하고 초탕이 재탕보다 높게 측정되었지만 분자량은 재탕이 초탕보다 높게 나타나 반대의 경향을 보였다. 그러나 PDI와 점도의 관계는 반비례 경향을 보였으며, 다양한 분자들이 혼재하여 오히려 결합을 방해하여 점도가 낮아진다는 연구와 일치하였다. 점도는 분자량과 PDI 모두와 관련이 있다는 연구(Schellmann et al., 2009)와 비교해 보았을 때, 본 연구에서는 소의 개체가 단 2마리에 불과하였기 때문에 오차가 생긴 것일 수도 있다고 판단된다. 이와 함께, 적외선분광분석에서 삼중나선의 파괴가 확인된 뱃가죽(F)에 대해서 점도와의 상관관계도 추가적으로 확인하였다. 적외선 스펙트럼에서는 B소에서만 Amide Ⅲ 영역의 피크가 낮아졌지만 점도는 A소, B소 모두의 뱃가죽의 재탕 아교에서 점도가 확연히 낮아지는 결과를 보였다. 이를 통해 뱃가죽이 등가죽보다 콜라겐의 분해 속도가 빠르다는 것을 확인하였다. pH의 경우, 추출조건에 따른 차이점은 발견되지 않았다. 일반적으로 아교(젤라틴)의 pH는 원료의 산 또는 알칼리 전처리에 따라 정해지게 되며 그 자체로 물성에 영향을 미치지는 않는다. 그러나 pH와 겔화온도의 상관관계를 확인한 연구에 따르면, pH 차이로 인해 젤라틴 분자 전하가 분자 간 가교형성을 방해하여 겔화시간에 영향을 미친다(Kim et al., 1995). 본 연구 결과에서는 추출 아교의 pH가 모두 비슷하게 나타나 이에 따른 영향은 비슷할 것으로 생각되나, pH가 겔화온도나 겔 강도 등의 특성에 영향을 줄 수 있기 때문에 추가적인 평가가 필요할 것으로 판단된다.
본 연구를 통하여 추출조건에 따른 우리나라 전통아교의 분자량, 구조 및 물성 변화에 대한 관계를 종합적으로 분석하였다. 본 연구와 같이 아교를 소량으로 추출할 경우에는 분석방법에 따라 가죽부위별, 추출시간별 아교 특성의 변화가 경향성이 있는 것도 있었지만, 소 개체별 차이가 큰 영향을 미쳐 추출조건에 따라서 정확한 변화양상을 예측하기 어렵다. 이는 원료 선정에 있어서 육안관찰을 통해서 동일한 것을 선택한다고 해도 생체조직의 특성상 차이가 있을 수밖에 없기 때문에 품질관리에 어려움이 생긴다. 따라서 1∼2마리 소를 대상으로 추출하기보다는 많은 소가죽을 대상으로 대량추출을 하여 오차를 줄이는 방법이 좋다고 판단된다.
향후 가죽의 전처리 방법 또는 추출온도 등 여러 가지 추출조건에 의한 변화를 분석하는 연구가 지속된다면 일정한 품질을 가진 아교 생산의 기초자료가 될 수 있을 것이다. 더 나아가 대량생산을 통한 전통아교 사용분야 전반에 적용할 수 있을 정도의 보급도 가능할 것으로 기대된다.
Acknowledgements
본 연구는 한국전통문화대학교 문화유산전문대학원 ‘전통 단청용 아교 품질 및 평가 기준 개발’의 일환으로 이루어졌습니다