|
 |
- Search
| J. Conserv. Sci > Volume 39(4); 2023 > Article |
|
초 록
본고는 한국의 깃털 문화유산 보존처리 현장 적용을 목적으로, 국내외 깃털 분석 방법 및 보존처리 기술 동향을 분석⋅정리한 기초연구이다. 깃털의 과학적 분석법 및 보존기술에 대한 연구는 북⋅남미권을 중심으로 깃털 문화유산 보존처리에 관한 연구가 체계적으로 이뤄져 온 반면, 국내에서는 다른 재질에 비하여 상대적으로 희소하여 주목받지 못하였다. 이에 본 연구에서는 국외 사례를 바탕으로 국내 깃털 문화유산에 보존처리 방안을 제시하고자 한다. 깃털에 대한 이해가 선행될 수 있도록 깃털의 구조와 재질 특성, 색상 등 기본적인 특성을 제시하였다. 깃털의 손상 상태를 파악하기 위한 자외선 및 아미노산 분석 뿐만 아니라, XRF 분석은 처리자의 안전에 영향을 줄 수 있는 살충제 등의 사용 유⋅무 또한 파악할 수 있어 중요하다. 이를 바탕으로 국내 깃털 문화유산에 적용할 수 있는 처리 전 조사와 세척, 접착⋅안정화, 복원, 포장⋅보관법을 구체적인 재료와 도구를 사례로 들어 제시하였다. 본 연구를 통하여 장식재료로 꾸준히 사용되어 온 깃털 보존처리에 대한 기반을 마련하고, 복합 재질 보존처리 영역이 확대될 수 있을 것으로 기대한다.
ABSTRACT
This paper highlights scientific analyses and treatments of cultural heritage made of feathers in Korea. While research on the conservation and treatment of featherwork has been systematically conducted in North and South Americas, it has not attracted much attention in Korea because featherwork has been rare. In many cases, if any, feathers have been used as a decorative material in composite works. In this study, we propose a conservation treatment plan for domestic featherwork based on foreign case studies of similar works. Basic characteristics such as structure, material characteristics, and colour are presented in order to establish a solid foundation of knowledge about feathers and to use this foundation for the basis of treatments. Analyses using ultraviolet rays and amino acid composition of feather will be explored to investigate the condition of feathers. XRF analyses are also an important tool to determine the presence of heavy metal pesticides on feathers. Upon determining the stability of feathers and presence of pesticides, treatments such as surface cleaning, stabilization, restoration, and packaging/storage methods will be presented using examples of specific materials and tools. It is hoped that the groundwork for conservation of featherwork and feathers in composite works in Korea will be launched through this paper.
깃털은 천연의 색감과 미감, 부드러우면서도 리드미컬한 움직임이 있는 장식 재료로서 동서양을 막론하고 독특한 장식의 소재로서 애용되어 왔다. 문화유산 분야에서 깃털에 대한 연구는 원주민의 전세 및 출토 유물이 남아있는 미국, 캐나다, 페루, 콜롬비아 등 북미⋅남미권을 중심으로 시작되었다. 이외에도 무대의상, 예술품 등 오브제 보존처리 전문가에 의해 1980년대부터 깃털 보존처리에 대한 과학적 분석조사를 병행하여 보존처리 방법 개선에 대한 연구자료가 꾸준히 축적되었다. 문화유산 분야에서 깃털에 대한 연구는 일찍이 Barton & Weik(1986), Silveira(1997), Dignard et al.(2003)의 선행연구가 있으며, 최근에는 Pearlstein(2014a; 2014b; 2017)과 Ciofini et al.(2022)의 연구가 있다. 특히 Pearlstein은 문화유산 현장에 적용할 수 있는 깃털 보존처리에 대한 이론과 보존처리 방법에 대한 체계적인 연구를 진행하였다.
이외에도 구체적인 깃털의 종류에 대한 선행 연구도 살펴볼 수 있으며, 동아시아지역에서 귀한 재료로 알려진 물총새 깃털에 대한 초기 연구로 Salzman & McCarthy (2002)의 연구가 있다. Zhu et al.(2019)과 Gu et al.(2021)의 연구에서는 물총새 깃털에 대한 보존처리와 함께 재질에 대한 과학적 조사를 병행하기도 하였다. 또한 물총새 만큼 유물에서 흔히 접할 수 있는 공작모에 대한 연구는 Cheung et al.(2014) 및 Harwood(2011) 및 Klapšt’Ová et al.(2015)의 꿩털에 대한 연구도 있다.
국내에서는 Lim et al.(2010)의 연구와 같이 삼국시대 종장판갑에 부착된 깃털에 대해 현미경 조사한 연구 사례가 있다. 한국에서는 전승된 깃털 문화유산이 차지하는 비중이 적어 연구의 수요가 낮은 실정이다. 깃털은 쉽게 빠지고 부러질 뿐만 아니라 해충 피해를 입기 쉬워 보존관리가 쉽지 않은 재질로, 한국에 전승된 깃털 문화유산이 19세기말∼20세기 초의 유물이라고 할지라도 보존상태가 좋지 않은 경우가 많으며, 타조, 꿩, 공작, 백조, 왜가리, 독수리, 극락조 및 앵무새 등의 깃털이 대부분 복식의 장식에 사용되는 것으로 알려져 있다. 그러나 현전하는 국내 유물 중에 깃털 고유의 외관 특성을 통해 종(種) 식별이 가능한 것은 꿩이나 공작, 물총새의 깃털 정도로 한정된다.
이에 본고는 깃털 문화유산 보존 연구에 있어 가장 기초가 되는 깃털에 대한 재질 특성을 정리하고, 국내외 연구사례를 토대로 현전하는 깃털 문화유산에 적용할 수 있는 과학적 조사방법과 보존처리를 수행할 수 있도록 보존 과학적인 전문 정보를 제공하는 데에 연구의 목적이 있다. 깃털 문화유산은 다른 재질에 비해 상대적으로 희소하지만 장식 재료로서 꾸준히 활용되어 왔다. 이에 국내에서도 깃털 문화유산 보존처리를 통해 복합재질에 대한 보존처리 기술 확보할 수 있으며, 나아가 유기질 보존처리의 새로운 확장 영역으로써 의의가 있다고 본다.
깃털은 조류의 몸을 덮고 있는 털로서, 피부에서 생긴 케라틴(keratin) 질의 보호기관으로 짐승의 털이나 파충류의 비늘과 발생학상의 기원은 같으나 공기층을 만들어 체온을 보존하고 몸의 비중을 가볍게 하여 비행할 때나 물에 쉽게 뜰 수 있게 한다.
새들의 몸은 다양한 형태의 깃털로 덮여 있으며, 깃털의 형태학적 특징을 통해 종(種)을 구별할 수 있다. 깃털의 형태는 새의 각 부위마다 각 특징이 두드러지기도 하여, 전신(全身), 얼굴, 꼬리깃, 깃털, 몸깃, 날개깃으로 구분한다. 또한 깃털의 모양과 위치에 따라 기능이 달라진다. 깃털의 분포는 새의 종류에 따라 다르다. 깃털은 형태와 색, 크기로 각각의 부위를 구분할 수 있다. 다양한 형태의 깃털이 규칙적으로 배열되어 있는 날개깃(primaries, secondaries), 꼬리깃(rectrices)들은 첫째날개깃, 둘째날개깃, 셋째날개깃과 첫째날개덮깃, 가운데날개덮깃, 작은날개덮깃, 큰날개덮깃, 작은날개덮깃 등으로 세분화된다(Figure 1)(Korea Korea National Park Research Institute Institute, 2020). 날개깃은 좌우 깃변 폭의 차가 크고 대형 조류인 경우에는 단차도 있다. 꼬리깃은 양변이 좌우대칭이고 첫째 날개깃과 둘째 날개깃은 선단부와 장식털의 세부 형태 등과 같이 외관 특징으로 구별이 가능하다.
하나의 깃털을 다시 상세히 들여다보면 Figure 2와 같이, 중앙의 축(軸)이 되는 깃대와 그 기부에 있는 깃뿌리, 깃판으로 구성되어 있으며, 깃판은 깃대의 좌우에 있는 깃가지와 작은 깃가지로 구분할 수 있다. 깃털의 형태에 따라 크게 두 종류(pennaceous/contour, plumulaceous)로 나누어진다. 몸과 날개, 꼬리를 덮고 있는 긴 깃털(pennaceous/contour)는 깃축(shaft), 날개(vane), 깃가지(barbs), 솜털(downy), 그리고 깃뿌리(hollow shaft, calamus)로 구성된다. 또한 깃가지(barb)와 작은 깃가지(barbule), 갈고리(hooklets) 등의 작은 부분들이 있는데, 이것들은 깃가지를 함께 잡고 깃털의 형태를 유지할 수 있다. 한편 솜털(plumulaceous)은 깃촉이 짧고, 깃가지 부분에 갈고리가 없는 대신 노드(node)가 있다. 솜털은 부드러운 촉감이 특징이다.
깃털은 약 90 %의 케라틴으로 구성되어 있다. 케라틴은 모든 단백질과 마찬가지로 아미노산(amino acid)으로 구성되어 있고, 많은 측쇄(side chain)를 포함하는 폴리펩티드 주사슬(polypeptide backbone)을 가지고 있다. 이 많은 측쇄 중, 시스테인(cysteine)은 단백질에 강도와 강성을 부여하는 이황화 결합(disulfide bond)을 형성하는 능력으로 인해 케라틴 단백질의 핵심 구성인 시스틴(cystine)을 만들어 낸다. 시스틴의 비중이 클수록 케라틴은 내구성이 강하고 단단해진다.
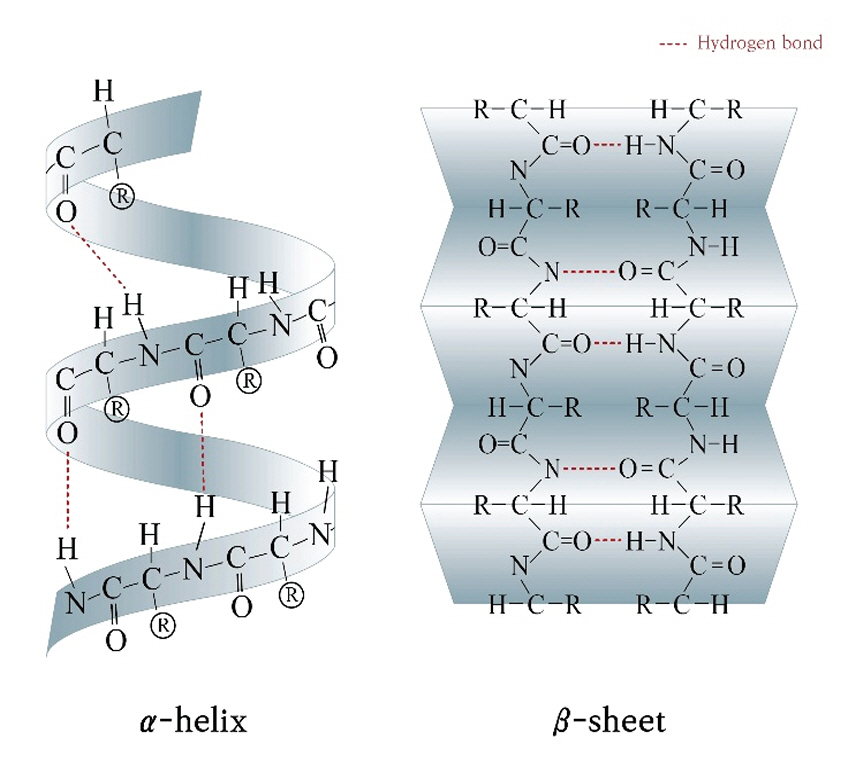
이러한 다양한 측쇄는 케라틴 섬유의 알파-나선(α-helix)이나 베타-병풍(β-sheet)과 같은 두 가지 방법으로 순차적 접힘을 허용한다(Figure 3). 케라틴으로 구성된 깃털은 베타-병풍(β-sheet)의 입체 주름 형태의 구조로, 단백질의 2차 구조이다. 병풍 형태의 규칙적인 베타-병풍은 깃털의 무게를 최소화하면서 구조의 안정성과 부피를 극대화하는 데 도움이 된다. 그러나 베타-병풍의 특정 부위에 극성(polar) 아미노산을 함유하고 있어 부위별 수소 및 비극성(nonpolar) 결합을 통해 인접한 병풍의 다른 아미노산을 끌어당긴다. 이렇게 하면 알파 나선 형태가 병풍 형태가 되는 수소 결합과 반데르발스 힘(van der Waals force)으로 인해 긴 선형 폴리머(linear polymer)로 풀리게 된다(Kim, 2014).
케라틴의 화학 결합 구조로 인해 깃털은 알칼리, 광산화물(mineral acids), 요소(urea), 강산화제에 약하며, 자외선이나 높은 온도 및 습도에 민감하다. 알칼리(alkali)는 산성환경(acid-base)에서 황(sulfur)을 환원(reduction)시켜 시스테인의 분해를 초래하며, 고농도의 요소(urea)는 수소 결합을 끊어 케라틴을 변성시킨다. 강산화제는 아미노산을 산화하고 다양한 결합을 끊고 샌드위치 형태의 베타 병풍 사이의 간격을 증가시켜 깃털을 탈색시킨다. 이로 인해 공간이 많아져서 깃털의 구조가 약하고 부서지기 쉽다. 마찬가지로 높은 온도에 노출 시에도 베타 병풍 사이의 공간이 증가하게 된다.
육안으로 관찰되는 깃털의 색상은 색소에 의한 색과 구조색(structural color)으로 분류할 수 있다. 색소에 의한 색은 베타-케라틴(β-keratin), 구조색은 멜라닌의 정렬 구조에 의해 구현된다. 구조색은 굴절률이 다른 물질들의 주기적 배열에 의해 발생된 빛의 산란이나 회절, 간섭이 발생하는 특징이 있어 보는 각도에 따라 색을 다르게 보이게 한다(Park, 2020). 까치의 깃털에는 흑색 혹은 갈색인 멜라닌 색소가 있음에도 청색의 광택으로 보이는 것은 미세한 기포에 의해 생기는 빛의 간섭 현상 때문이다. Figure 4는 깃속이 비어있는 멜라노솜(melanosome)을 확인할 수 있는 깃털 단면의 주사전자현미경(Scanning Electron Microscope; SEM)사진이며, Figure 5는 깃털의 표면에서 발생하는 빛의 간섭 현상을 도해한 것이다. 상세히 설명하자면, 청색이 베타 케라틴이 형성될 때 깃털의 작은 깃가지 위쪽 표면 근처에서 스스로를 조직하여 수백만 개의 일정한 크기의 작은 공기 주머니를 만드는 방식에서 비롯된 것이다. 즉 청색 깃털의 경우 스펀지와 같은 패턴의 단백질과 공기 공간이 파란색을 모든 방향으로 흩어지게 하면서 빨간색과 노란색 빛의 파장이 사라진다. 청색의 명도는 ‘케라틴-공기 주머니(keratin-air matrix)’ 복합체의 다양한 크기와 모양을 반영하는 것(Ksepka, 2016)으로, 공작의 다채로운 색상은 ‘케라틴-공기 주머니’ 격자 패턴과 관련이 있다고 할 수 있다. 격자 패턴에는 다양한 크기의 많은 공기를 채울 수 있는 공간이 있어 빛이 표면에 닿으면 다양한 각도에서 빛이 반사되고 서로 상호 작용하여 총천연색을 형성하게 된다.
깃털의 색상은 카로티노이드(carotenoid)과 멜라닌(melanin), 포르피린(porphyrin)을 포함한 여러 색소의 존재가 깃털 색을 결정한다. 새는 스스로 멜라닌과 포르피린을 만들어 낼 수 있지만 카로티노이드는 식물에서만 생산되기 때문에 먹이로 공급받아야 한다. 카로티노이드는 보통 주황색, 노란색 또는 빨간색이다. 카로티노이드 색소는 식물에서 합성되고, 새의 소화기관에 의해 소비되고, 깃털이 자라면서 난포(follicle) 세포에 의해 운반된다. 멜라닌은 동물이나 새들에게도 있는 검은색에서 갈색의 색소이다. 깃털에 색을 더해주는 것 외에도 멜라닌은 깃털을 더 촘촘하게 만들어주고 햇빛에 의해 마모되고 분해되는 것을 더 잘 보호한다. 포르피린은 세포가 깃털 난포에서 생성하는 녹색, 밤색, 분홍색과 빨간색 색소이다.
깃털의 미세구조나 생물색소로 인해 발색되는 모든 깃털은 자연광에 의해 변색되며, 생물색소에 비해 반사광택에 의해 색을 내는 경우가 내광성을 지니는 것으로 알려져 있다(Pearlstein et al., 2014b). 깃털이 어떻게 발색되는지 파악하는 것은 깃털의 종류와 특성을 이해하는 것뿐만 아니라, 문화유산 현장에서도 어떻게 보존처리하고 관리해야 하는 지 지침을 마련하는 데에도 중요한 기준이 될 수 있다. 선행연구에 따르면, 나노 스케일 단백질 구조를 통해 빛의 산란으로부터 파생된 색상의 깃털은 생물 색소를 기반으로 한 깃털보다 빛에 대해 더 안정적이다(Pearlstein et al., 2014b). 이에 깃털 문화유산 보존처리 전에 반드시 깃털의 색상에 대한 상세 정보를 판별하거나 적어도 어느 계열의 색소인지 추정할 수 있어야 한다.
깃털을 유지 및 보존하기 위한 새들의 생태학적 특성으로, 털갈이(molting)와 털 고르기(preening)가 있다. 깃털은 먼지, 오물 및 기생충을 제거하기 위해 매일 여러 번의 손질이 필요하다. 또한 새들은 체형에 따라 각 깃털을 최적의 위치에 재정렬 해야 하며, 이러한 새들의 행동은 새들의 건강에도 매우 중요하다. 깃털은 피부처럼 재생되지 않고 깃털이 새로 나오며, 이는 새들의 나이, 건강, 주변 환경에 따라 좌우된다. 어린 새의 깃털은 다 빠지고, 성조(어미새)의 크기에 맞게 깃털은 다시 자란다. 털갈이는 모든 깃털을 교체할 수 있고, 일부만 교체하기도 한다. 새들이 털갈이를 하는 데에는 많은 영양분을 필요로 하므로 항상 먹어야 하며, 스트레스와 영양실조에 걸리면 많은 깃털을 잃게 된다. 비행 중에 깃털이 빠지는 것은 자연스러운 일이며, 새로운 깃털이 자라서 대체된다. 한편 비행을 위한 깃털과 달리 수컷 새의 경우 짝짓기 기간에 장식 깃털이 매우 중요하며, 평소보다 더 많은 영양분을 필요로 하게 된다.
한편 털 고르기(단장, preening)은 부리를 사용하여 꼬리 부분의 피지선(uropygial gland, preen gland)에서 분비되는 기름을 부리를 사용하여, 깃털에 그 기름을 고르게 퍼뜨리는 것이다. Preening oil의 성분은 깃털을 방수하고, 깃털에 수분을 공급하여 부러지지 않도록 깃털의 강도를 높이고 보다 유연하게 할 수 있다. 또한 깃털이 비행의 스트레스에 대한 내구성을 부여하게 된다. 이외에도 각종 외부 환경에서 비롯되는 박테리아, 해충으로부터 안전하게 하며(Giraudeau et al., 2013; Braun et al., 2018), 최적의 방수 및 단열을 위해 깃털을 정렬하면 물에 젖거나 극심한 고온 또는 저온과 같은 극한 상황으로부터 깃털을 보호하고 보다 효율적으로 비행할 수 있게 한다(Moreno-Rueda, 2017; Sandilands et al., 2004).
이상의 새들의 행동특성을 참고로 하여, 깃털 문화유산에 대한 정확한 이해와 과학적 분석 및 보존처리의 설계가 가능하다고 본다. 박제품이나 문화유산에 활용된 깃털에 대한 최상의 보존 상태를 유지할 수 있는 preening oil의 대체 약제 개발과 처리 방법이 고안될 필요가 있다고 본다.
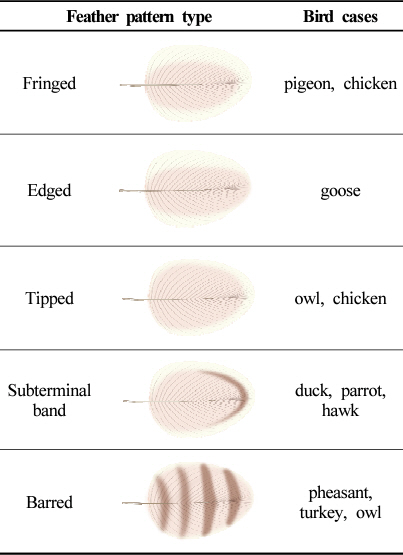
다양한 환경에 다양한 새가 있기 때문에 일반화하기가 쉽지 않다. 전통적인 깃털 식별은 크기, 색깔, 패턴을 포함하여 물리적인 특징에 기초할 수 있다. 이외 서식지 등의 주변 환경 정보도 도움이 될 수 있다. 깃털 샘플은 깃털 ‘데이터베이스(Featherbase)’ 및 ‘깃털 아틀라스(Feather Atlas)’에서 깃털 이미지와 비교하거나 박물관 자료로 등록된 조류 표본과 비교를 통해 최종적인 결과를 얻을 수 있다(Figures 6, 7). 깃털 샘플이 느슨해졌거나 부러진 경우도 식별이 가능하다. 앞서 언급하였듯이 다양한 형태의 깃털이 있으며, 종마다 각 특징이 두드러질 수 있는 몸, 얼굴, 꼬리깃, 깃털, 몸깃, 날개깃으로 구성되어 있다. 깃털을 식별하는데 중요한 물리적 특성 중 하나는 문양의 형태이다. 크게 다섯 가지 종류로 구분되며, 각 문양 패턴이 해당되는 새의 종류는 일반적으로 Table 1과 같다.
특히 조류 충돌(bird-strike) 관련 DNA 분석 데이터가 상당량 축적되어 있지만 털 시료와 마찬가지로 출토 깃털의 경우에는 매납 환경에 의한 깃털 성분의 상실과 오염, 손상(Figure 8) 등으로 형태만 유지되는 경우가 대부분이기 때문에 색이나 문양패턴의 관찰은 물론 성분분석이 불가능하다.
출토 깃털에 비해 깃털의 형태와 크기가 양호한 경우에는 SEM과 같이 고배율 현미경 관찰로 솜털 결절 구조(Figure 9)를 확인할 수 있다. 솜털 결절 구조를 알 수 없거나, 완형의 깃털이 아니며 색상이 변질된 경우에도 깃털의 형태 및 크기를 파악하는 것은 동정의 중요한 단서가 될 수 있다.
깃털의 외형과 축의 단면과 길이를 육안관찰을 통해 측정하고, 실체현미경을 이용하여 절단한 깃축 단면과 날개 깃가지를 관찰한다. 깃가지는 특히 전자현미경(Transmission Electron Microscopy; TEM)로 관찰할 수 있다. 간단히 말해서, 깃털 샘플을 탈수 후에 수지에 포매시키고, 2 %의 3 nm 두께로 MIRA3 LMH 필드 방출로 관찰된 금(백금)코딩해야 한다(Stravenga et al., 2018). 한편 주사전자현미경을 사용하는 경우에는 각각의 깃털 시료는 시료대에 카본테이프로 접착하여 샘플링한 후 이온 증착기(ion sputter coater)로 진공, 80초간 백금(Pt) 코팅하여 주사전자현미경으로 관찰한다(Lim et al., 2010). 특히 오리나 맹금류(raptor) 또는 연작류(passerine)의 경우, 깃털의 솜털 부분을 미세하게 관찰하는 것이 종의 식별을 좁히는데 중요한 단서를 제공할 수 있다. 주사전자현미경을 통해 깃축 및 깃가지의 고리구조, 깃축의 단면 형태, 솜털의 결절구조 형태와 밀도를 관찰한다.
관찰 시, 솜털 결절 구조와 밀도 외에 깃털 단면에서 일반적인 타원형 외에 특징적인 형태를 확인할 수 있다. 청둥오리의 경우 단면의 원형, 꿩은 오목형, 공작은 볼록렌즈 형태를 띠며, 공작 깃가지와 청둥오리의 녹색 깃털에서는 고리구조가 확인되지 않는다고 한다.
새는 빨강, 녹색, 파랑 및 근자외선(Ultraviolet; UV) 파장의 네 가지 색소를 감지할 수 있는 눈을 가지고 있다. 특히 깃털의 근자외선 색소는 짝짓기 준비중인 새에게 중요하다. 짝짓기를 앞두고 털갈이한 깃털은 화려하고 근자외선 색소가 선명하며, 자외선 색소는 화학적 색소 또는 빛의 파장을 차등적으로 반사시키는 생물학적 구조에 의해 생성된다. 우리는 이 정보를 사용하여 깃털의 상태를 감지할 수 있다. 다양한 깃털 영역의 반사 스펙트럼(reflection spectrum)은 분광분석을 적용할 수 있다. 보존처리 현장에 있어 깃털 색상의 퇴색 감지는 자외선 유도 형광 분석(Ultraviolet-Induced Visible Fluorescence; UVIVF)을 활용할 수 있으며, 주로 365 µm 파장대를 사용하여 이뤄지고 있다. 깃털의 퇴색이 감지되기 전 광화학적으로 유발된 퇴화를 감지하기 위해 자외선 유도 가시 형광 변화를 케라틴의 화학 및 색소 농도의 변화와 연결된다. 깃털 케라틴의 광산화(photo-oxidation)는 체계적으로 연구되지 않았지만, 광산화에 따른 시스테인과 시스틴의 비율은 자외선에 더 많이 노출될수록 증가하는 것으로 알려져 있다. 때문에 분석 결과를 통해 과거의 빛 노출에 대한 정보를 추정할 수 있다. 자외선 형광 검사를 통해 눈으로 색상 변화를 감지하기 전에 광화학적 변화의 초기 증거를 확보하여 깃털 색상의 변⋅퇴색을 예방할 수 있다(Pearlsterin et al., 2014b). 케라틴의 분해에 의해 생성되는 류신(leucine), 아스파라긴(asparagine), 티로신(tyrosine), 알라닌(alanine) 및 글리코콜(glycocoll)은 자외선 유도 형관 분석 시 형광을 띤다(Hirst, 1927).
또한 자외선 유도 형광분석은 일부 생물 색소의 경우 자외선에 반응하므로, 깃털 동정에도 한정적으로 활용될 수도 있다(Pearlstein, 2017). Durrer(1977)는 깃털의 색이 베타 케라틴과 멜라닌, 공기층의 정렬 방식 의해 변화한 다는 점에 착안해, 이를 종합하여 깃털의 종류를 6가지로 구분하였으며(Stravenga et al., 2018), Huth & Burkhardt(1972) 이후 깃털의 UV 반사를 통한 종 식별의 긍정적인 증거를 제시하는 연구가 꾸준히 발표되고 있다(Mullen & Pohland, 2007). 앵무새는 형광 깃털을 포함할 가능성이 높으며(Pohlnad & Mullen, 2006) 유황앵무(Cacatua)속의 새들은 자외선 유도 형광 분석 시 거의 흰색이거나 매우 옅은 노란색을 띤다. 갈색계의 올빼미나 부엉이 깃털의 경우에는 분홍색 빛의 보라색 형광을 띤다. 즉, 자외선 유도 형광 분석은 프시타코풀빈(psittacofulvin)이나 포르피린 생물 색소를 포함한 깃털의 종 식별에 활용할 수 있다. 포르피린은 특히 자외선 아래에서 밝은 빨간색을 발산하는 것으로 알려져 있다.
깃털의 색소는 대체로 세 가지 종류가 있으며, 카로티노이드(carotenoid), 멜라닌(melanin), 포르피린(porphyrin). 각 각은 UV에 대해 다른 반응을 보인다. 카로티노이드는 깃털의 카로티노이드 색소 침착을 파괴하기 때문에 빛과 자외선에 민감하다. 이러한 안료 색소 감소는 UVIVF에서 형광성의 저하로 나타난다. 포르피린도 빛에 민감한데 포르피린의 형광으로 깃털의 나이에 관계한다. 새로 털갈이한 깃털의 형광은 올빼미와 같은 조류에서 강한 형광색을 띄고 1년 이상 된 깃털은 형광색을 띄지 않거나 흐리다. 세 가지 색상 중에서 멜라닌은 일부 UV에 대한 보호를 위해 스스로 합성되었기 때문에 빛에 가장 안정된 색소이다. 그러나 UV에 지속적으로 노출되면 깃털의 케라틴 구조가 손상된다.
선행 연구에 따르면 깃털의 UV 반사율 스펙트럼은 다채로운 색상의 깃털일수록 종을 구분할 수 있는 특성이 있으며, 흰색이나 흑색 깃털로 종의 특성을 분석하는 것은 오류가 있을 수 제외되고 있으니 분석 적용에 주의가 필요하다. 빛의 조사 각도에 따라 색이 바뀌므로 자외선 조사 각도와 거리를 균일하게 하고 이를 기입하는 것이 필요하다.
특히 깃털 문화유산 보존처리 설계에 있어, 깃털의 색소 침착 시스템을 확인하는 것은 매우 중요하다. 염색되지 않은 깃털을 퇴색시키는 데에 필요한 빛의 양 차이는 깃털에 존재하는 착색 시스템과 빛 방출 스펙트럼에 따라 10배가 될 수 있다(Pearlstein et al., 2014b). 색소가 직접 형광을 나타내지 않은 깃털의 빛 노화의 결과로써, UV 광원 조건에서 깃털의 외관 변화가 나타날 수 있으며, UV 유도 형광에서 볼 수 있는 색상 변화를 통해 깃털의 광화학적 변화를 초기에 감지할 수 있다고 본다. Figure 10은 광원을 달리하여 UV 유도형광 반응 등 광학적 변화를 비교관찰 한 것이다. 그러나 일부 깃털의 생물 색소의 안정적인 속성으로, 비파괴 UV 형광 분석은 깃털 문화유산의 식별과 및 색소 정보를 제공할 수 있지만 빛 노출 등 깃털을 손상시킬 수 있으므로 각별한 주의가 필요하다(Pearlstein et al., 2014b).
깃털은 단백질 물질로 구성되어 있으므로, 광 유도 분해의 지표로서 단백질 아미노산 분석을 적용할 수 있으며 극 소량의 시료를 필요로 한다. 즉 산화의 정도를 분석하여, 노화의 초기 지표가 되는 색상의 변화를 파악할 수 있다. 깃털 케라틴의 화학 구조의 광산화는 시스틴 아미노산의 이황화결합(disulfide bond)을 파손시키며, 분광법이나 크로마토그래피(chromatography)를 통해 감지할 수 있다고 본다.
아미노산은 단백질의 기본 구성단위로, 그 구성과 배열의 순서에 따라 다른 특성을 갖는다. 아미노산은 단일 결합(single-bond)으로 이루어져 UV/Vis에서 흡광을 갖지 않아 유도체화하여 분석한다(Park et al., 2015). HPLC와 GC-MS, 아미노산 자동분석기 등이 대표적인 분석기이다. HPLC를 사용할 경우 자외/가시광선 흡광도를 갖도록 형광 유도체화하며, CG는 휘발성을 부여하는 유도체화 과정이 필요하다. 아미노산 자동분석기는 분리한 아미노산을 닌하이드린(ninhydrin reagent)과 반응시켜 UV/Vis로 검출하는 방식이다(Kim et al., 2004).
다른 재질과 달리 깃털의 보존상태 진단에서는 살충제 성분에 대한 확인이 필요하다. 깃털에 벌레에 의한 손상이 없고 상태가 양호하면 중금속 살충제 잔류물이 있을 가능성이 높다. 수은 또는 비소 살생물제 처리는 19세기와 20세기에 박물관 소장품에 광범위하게 사용되어 섬유 및 자연 환경 수집품의 곤충 손상 및 곰팡이 성장을 방지했다. X-선 형광분석기(X-ray Fluorescence; XRF)를 통해 조사가 가능하며, 조사 시 고려해야 할 중금속으로는 수은(Hg), 비소(Hs), 카드뮴(Cd), 납(Pb) 등이다.
깃털에서 XRF로 중금속을 검출하기 위해서는 깃털 표면과 잘 접촉해야 하고 충분한 양의 깃털이 필요하다. 분석할 때 염두 해 두어야 할 두 가지 중요한 사항은 Prolene® film을 사용하여 다른 깃털 사이의 살충제 교차 오염을 방지하는 것과 개인보호장비(Personal Protective Equipment; PPE)의 착용이다. 형광분석을 통해 중금속의 살충 성분을 확인하며, 보존처리 과정에서 보존처리 환경 및 작업 환경의 안전을 위해 기계 환기는 물론 장갑을 비롯한 보호구가 반드시 필요하다. 이러한 보이지 않는 독성 처리에 대한 주의는 수집품이 공공 행사 및 대여에 사용되는 경우에도 고려해야 한다. 깃털에서 살충제 검출을 표준화하는 것은 캐나다와 미국에서 아직 개발 단계에 있다.
복식에 사용되는 깃털의 종류는 다양하지만, 우리나라에 현전하는 깃털 문화유산의 종류와 유형을 살펴보면 다음의 Table 2와 같이 공작모와 꿩털, 물총새 정도가 대표적이라 할 수 있다. 대체로 복식유물과 생활유물에서 사용된 경우로, 깃털의 종류는 공작모와 꿩털은 전립 등의 장식에 사용하고, 부채나 빗과 같은 장식용 생활용품에서도 확인된다.
현전하는 공작모를 장식으로 하는 전립(氈笠)은 무관(武官) 복식의 한 구성으로, 19세기 말 또는 20세기 초에 국외로 반출되기도 하였다. 공작은 꿩과(phasianidae)이기는 하나 한국에는 서식하지 않으며 주요 서식지는 인도, 말레이시아, 미얀마, 중국의 남부지역으로 알려져 있다. 문헌에서도 고려는 송을 통해 공작모를 수입했으며, 조선은 류큐[琉球]와 중국, 일본 등지에서 공작모를 수입했다고 문헌에 기록되어 있다. 꿩털은 대체로 꿩의 긴 꼬리깃털을 사용하는데, 깃발이나 돛의 윗부분 등에 장식하여 ‘꿩장목’이라고 부른다. 이와 유사한 목적으로 화살 장식에서도 꿩털을 확인할 수 있다. 물총새 역시 우리나라에서 서식하지 않음에도 불구하고, 매우 희귀한 깃털 재료로 영친왕비 장신구의 비취색을 내는 데에 활용된 것을 확인할 수 있다. 이외에도 대한제국 시기의 서양식 예복과 예모(禮帽)에 사용되는 각종 털도 남아 있으며, 일부 연구 자료에 따르면 타조털로 추정하고 있다.
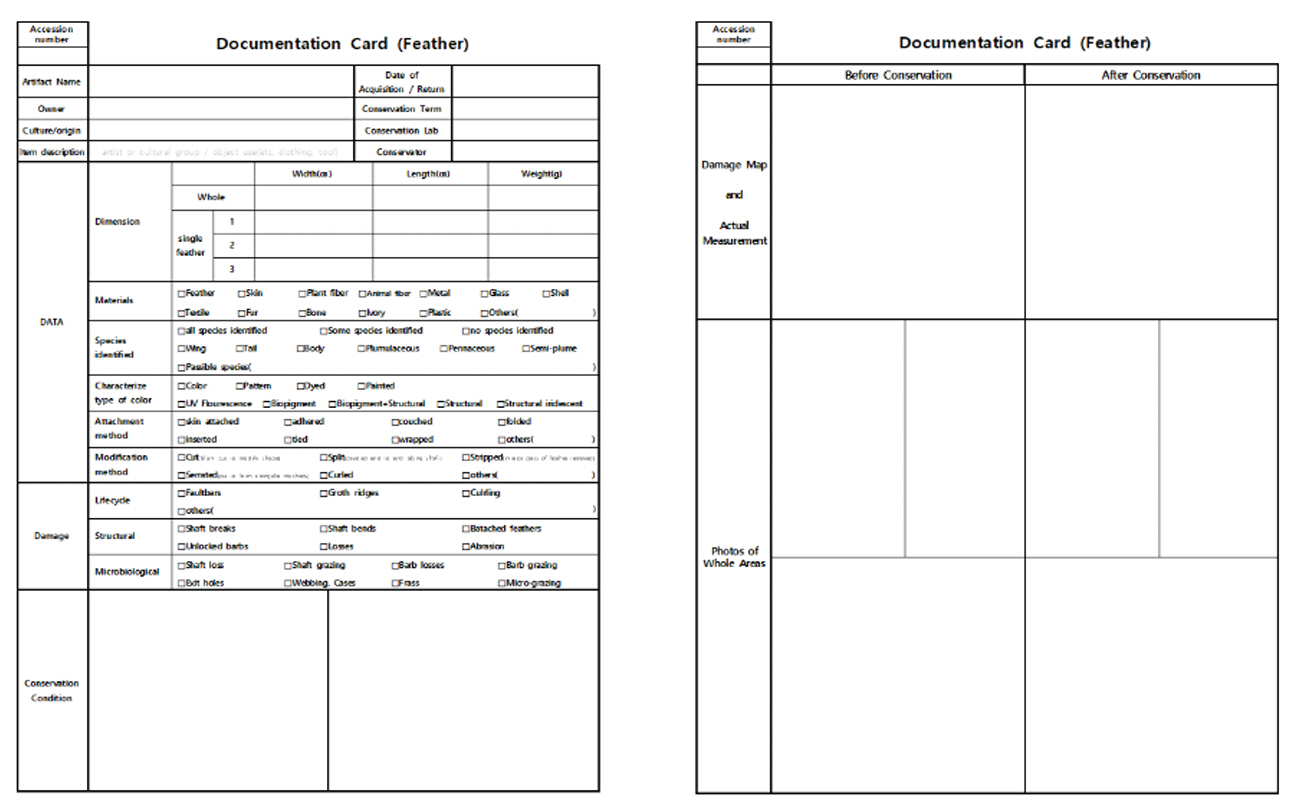
본격적인 보존처리 전에, 깃털의 장식 기법에 대한 관찰과 손상의 유형과 원인에 대한 통찰이 수반되어야 한다. 대체로 깃털을 장식 재료로 활용할 때, 염색(dyeing), 묶기(binding), 심기(planting), 컷팅(cutting), 누빔(quilting), 니팅(knitting), 비딩(beading), 술장식(fringe & tassel)의 공예 기법이 활용된다(Park, 2005). 주요 손상 유형은 생물 색소의 퇴색, 깃대 등 부러짐과 같은 물리적 손상, 깃털의 유실, 충해로 인한 결실, 각종 먼지 외에 살충제 등에 의한 오염 등이 있다. 이외 깃털의 종류와 구성 및 재질 특성, 과거 보존처리 이력 등에 대한 상태를 조사하여 기록한다(Figure 11). 전체적인 육안관찰 후, 자외선 유도 형광 분석 등의 과학적 분석 장비를 활용하여 정밀 조사와 재질 분석 등을 실시하며, 그 결과는 보존처리 방향과 재료를 선택하는 근거 자료가 된다. 문화유산의 상태에 따라 적합한 조사 방법을 적용하여야 한다. 기본적으로 비파괴 분석을 원칙으로 하되, 상황에 따라 미량의 시료나 탈락된 깃털 시료를 채취하여 분석 시 활용할 수 있다.
세척은 얼룩과 이물질 등 오염물을 제거하는 과정으로 유물에 고착된 이물질을 최소화하고, 깃털의 분자 내 수분함량을 높여 세척 전보다 유연하고 강하게 만들어 준다. 세척의 방법은 건식 세척과 습식세척 등이 있으며, 습식 세척방법과 횟수는 깃털의 보존상태 및 생물 색소의 특성 등 깃털의 특성에 따라 다르게 적용하지만 대체로 3회 내외로 실시하는 것이 좋다. 습식 세척이 어려운 경우 부분 세척을 통해 오염물을 제거할 수 있으며, 깃털의 앞〮 뒷면에 흡습지를 편평하게 깔고 탈이온수 등을 가늘게 분사하여 유물 표면의 오염물을 흡착시킴으로써 깃털을 깨끗하게 할 수 있다. 휴대용 석션기나 셕션테이블 등의 기자재를 활용할 수도 있다. 깃털 세척 과정에서는 박테리아나 살충제와 같은 오염물도 배출되므로 환기시설은 물론 마스크, 장갑, 작업복 등의 보호 장비를 착용해야 한다. 다만, 장갑을 끼면 깃가지가 가지런히 정렬(alignment)되었음을 느끼기 어렵기 때문에 깃털에 유독하고 위험한 요소가 포함되어있지 않다고 확신하는 경우 더 정밀한 작업을 위해 깨끗한 손으로 깃털을 다듬는 것을 권장한다. 미국 자연사 박물관(American Museum of Natural History)의 Julia Sybalsky는 깃털 세척에 대한 매뉴얼들을 하나로 집약해 ‘Feather Cleaning Guideline’를 만들었다(American Museum of Natural History, n.d.). 본 논문에서는 가장 기본 요소만 다루고자 한다.
깃털이 매우 가늘고 쉽게 부러질 수 있기 때문에 부드러운 붓과 면봉, 스펀지, 가는 대칼과 같이, 보존처리 과정에서 물리적 손상을 예방할 수 있는 세심한 도구 선택과 주의가 필요하다. 유물 진공청소기에 실리콘 호스나 플라스틱 피펫(plastic pipette)을 연결하여 사용할 수 있으며, 깃털 표면에 고착된 오염물, 특히 곤충의 알이나 분비물 등도 섬세한 핀셋, 대나무 소재의 뾰족한 도구(bamboo skewer) 등을 이용하여 완전히 제거하거나 전체적으로 완화시킬 수 있다(Table 3, Figure 12).
습식 세척은 건식 세척만으로 이물질이 완전히 제거되지 않을 때 적용할 수 있다. 습식 세척 전에는 생물 색소나 물리적 손상이 발생되지 않도록 예비테스트를 실시하여야 한다. 건식 세척으로 깃털 표면의 이물질을 제거한 뒤(Figures 13, 14), 세척과정 중 이물질로 인하여 발생할 수 있는 얼룩이나 찢어짐을 예방하도록 한다. 탈이온수를 사용한 세척은 수용성 오염물을 제거하는데 효과적이나 수축⋅팽윤⋅변형 등 형태 변형과 이염 등 손상이 발생할 수 있으므로 각별히 유의하여야 한다. 세척효과를 향상시키기 위해서 계면활성제나 첨가제(오염 재부착 방지)를 사용할 수 있으며, 디하이폰(Dehypon®) 또는 모노겐(Monogen®)을 사용할 수 있다. 모노겐은 카제인(casein)/유청(whey) 혼합물이 포함되어 있어 곤충을 유인하고 결과적으로 해충 피해로 이어질 확률이 높기 때문에 북미 박물관에서는 더 이상 사용을 권장하지 않는다.
최근에는 보존 펜슬 또는 초음파 분무기(ultrasonic humidifier, nebulizer)와 같은 장비를 활용하여 25∼100°C의 수분을 분사하면서 세척과 동시에 습도를 부여하고, 왜곡된 형태를 서서히 바로잡을 수 있다. 경우에 따라 SympaTex®와 같은 투습⋅방수포의 성질을 활용하여, 가습 효과를 줄 수 있다. Figure 15는 깃털의 습식 세척 전후를 비교한 것이다.
깃털 자체가 약해져서 다른 물질의 주입(impregnation)이 필요하거나 보존처리 과정 중 탈락의 우려가 있는 부분에 접착제를 사용하여 안정화 시키는 작업이다. 안정화 처리는 구조적으로 불안정한 깃털의 일부분을 보존처리 접착제로 연결하거나, 복원하는 과정을 포함한다(Table 4). 일반적으로 사용되는 재료로, 아크릴계(acrylic) 접착제를 사용하는 것으로, 3대 1의 비율로 배합한 Lascaux® 498과 360HV이거나 PVA 중성 접착제이다. 이외 Jade 403, Jade R도 사용된다. 강화제를 도포하여 처리하며, 횟수와 농도는 보존 상태에 따라 조절하여 작업한다. 또 다른 방법은, 수용성 셀룰로오스계 접착제인 2% (w/v) Metocel™ A4M를 증류수에 희석하여 사용하거나 Klucel G를 활용하기도 한다(Figures 16, 17). 한편 Figure 18과 같이 Paraloid™ B-72 펠렛(pellet)을 늘여 사용할 수도 있다.
이상 약품을 선택을 위해 유물의 탈락한 시편이나 유사시편을 활용하여 약품 및 농도에 따라 예비테스트를 실시한다. 약품의 장점과 단점과 처리 효과를 파악하여 보존처리에 적용할 재료 및 농도를 결정한다. 약품이 뭉침, 주변에 직물에 스며들거나 얼룩이 생기지 않도록 주의가 필요하다. 안료나 직물의 색 변화나 광택 변화가 없어야 한다. 강화 수지의 온ㆍ습도 등에 따른 상태 변화로 인한 단점도 유념해야 한다.
보강 및 복원 작업은 깃털 부분이 충해, 빠짐 등으로 인해 깃털이 결실된 부분에서 주로 필요하다. 깃털의 세부 구조에서 복원이 가능한 것은 대개 깃대, 깃 부분이다. 깃대는 대나무꼬치와 같이 단단하면서도 유연한 재료를 사용하며, 깃 부분은 폴리에스터 방적사(spun-bound polyester)이나 한지로 복원한다. 이 때 접착제는 BEVA 371이나 Lascaux®을 쓸 수 있다. 결실부 보강 시 보강재료 없이 적용하는 경우도 있지만, 보강 재료를 필요로 하는 경우에는 보통 다양한 두께의 폴리에스터 방적사나 면사를 활용할 수도 있다(Figure 19). 복원 재료에 대한 인공 열화를 거침으로써, 보강에 의한 인장응력을 최소화하고, 고색(古色)을 구현하여 본 유물의 미관을 해치지 않는 장점이 있어 보존처리 재료로서 논의되어 왔다. 일광(sunlight) 또는 자외선 등의 빛과 고온, 습도, 전자선(electron beam) 등에 의해 열화를 가속시킬 수 있으며, 각기 다른 열화 거동을 보인다.
방균ㆍ방충의 목적으로 곰팡이 및 벌레 등 생물학적 피해를 예방하기 위한 소독작업으로, 장기적인 보존관리에 목적으로 소독을 실시한다. 오염이 심한 경우에는 훈증제 Hygen-AⓇ (HFC134a 8 5 % + Ethylene Oxide 15 %)를 사용하거나 냉동 시스템이나 질소 충전 등의 방법으로 생물학적 피해를 줄일 수 있다. 보관 상자나 공간에 조습제와 방충제를 함께 넣을 수도 있다. 생물 피해 예방에 있어 온ㆍ습도 관리도 중요하며, 습도 인디케이터를 유물과 같이 두어 적정 습도를 쉽게 식별할 수 있다. 깃털 문화유산 보존에 필요한 습도는 45∼55 % RH 이며, 온도는 15∼24℃이다.
깃털은 생물 색소를 포함하고 있으며, 이로 인해 쉽게 변색되거나 퇴색될 수 있으므로 조도관리가 수반되어야 하며, 대개 화려하지 않은 흑색 계열의 깃털은 150 lux 이하, 염색된 깃털이나 열대 깃털의 경우 50 lux 이하에서 보존⋅관리해야 한다. 먼지와 빛 노출로부터 보호하기 위해 커버가 필요하며, 섬유 린트(lint)가 발생이 적은 타이벡(Tyvek®)이 유용하다. 깃털 문화유산은 형태에 따라 평면 또는 입체 상태로 보관하는데, 타이벡 솜포 등을 넣어 유물의 보관과 이동 중에 상자 내부의 흔들림에도 유물의 형태를 유지할 수 있어야 한다.
깃털은 동서양을 막론하고 장식의 목적으로 선호했던 재료이지만, 쉽게 손상되는 재질 특성으로 인해 국내의 문화유산 현장에서 조차 보존처리 대상으로서 인식하지 못하였다. 최근 들어 우리나라에서도 다양한 재질분야뿐만 아니라 근ㆍ현대 문화유산까지 보존처리 가 확대되고 있다. 깃털 문화유산 보존처리는 현재의 유기질 문화유산의 기술을 응용 및 활용 가능한 영역이지만, 보존처리 현장에서 취급하기 어려운 재료이기도 하다. 향후에는 깃털을 문화유산 재료로서 인식하고 전문적인 보존처리 기술에 대한 연구가 필요하다.
우선 깃털이 사용된 문화유산의 원형을 보존하기 위해서는 재질, 오염물질 및 재질의 열화 및 손상 메커니즘에 대한 조사를 통해 현 상태에 적합한 보존처리 방향과 지침을 설계할 수 있어야 한다. 이에 깃털 문화유산에 구조적인 이해가 선행되어야 하며, 실체현미경이나 SEM과 함께 TEM을 통해서 확인할 수 있다. 깃털의 식별 및 동정은 크게 외형의 형태와 크기, 색, 문양패턴 등 육안관찰을 이용한 방법과 주사전자현미경을 이용한 솜털 결절의 형태와 결절의 배치, 밀도 등의 세부 관찰을 통해 가능하다. 깃털 문화유산의 오염 물질은 착용, 빛, 열, 매장 등 다양한 환경으로부터 기인되며, 보존상태 조사를 위해 자외선 유도 형광 분석, 아미노산 분석 등을 적용할 수 있으며, 중금속을 포함한 살충제 분석은 X선-형광분석(XRF)뿐만 아니라 적외선분광분석(FTIR), 기체 크로마토그래피-질량분석(GC-MS) 등을 병행하는 것을 제안할 수 있다.
깃털 보존처리는 지류나 직물, 피혁류에 적용되는 세척 방법을 응용할 수 있으며, 특히 깃털의 미세 구조에 가습 작업이 매우 중요하다. 보존상태 및 목적에 따라 결실된 깃털을 복원할 수도 있다. 금번의 연구를 통해 국내 보존처리 현장에서 깃털 보존처리에 대한 필요성에 대해 제고하고, 깃털 보존처리의 가장 기초적인 이론과 보존처리 지침에 대해 정리하였다. 이를 통해 깃털도 문화유산 재료로서 지속적인 관심과 보존처리 방법 개선을 위한 의사 시편 실험을 통해, 분석과 보존처리 방법이 개선될 수 있을 것을 기대된다.
사 사
본 논문은 국립문화재연구원 문화재보존과학센터의 문화재 조사연구(R&D)의 지원을 받아 수행되었으며, 2022년 12월 26일 개최된 문화재보존과학센터 국외 전문가 초청 「Feather Conservation Workshop」의 발표 자료를 수정ㆍ보완하여 작성하였다.
Figure 1.
Composition of primary and secondary flight feathers. Reprinted with permission. (Illustrated by the Kyoung-Soon Jin (2019), from Korea National Park Research Institute)

Figure 4.
SEM of feather barbules, showing the cross-sectional view of hollow melanosome layers. Reprinted from “Magnificent magpie colours, by feathers with layers of hollow melanosome, by D.G. Stravenga et atl., 2018, Journal of Experimental Biolgy 221(4), Copyright 2017 by The Company of Biologists”.
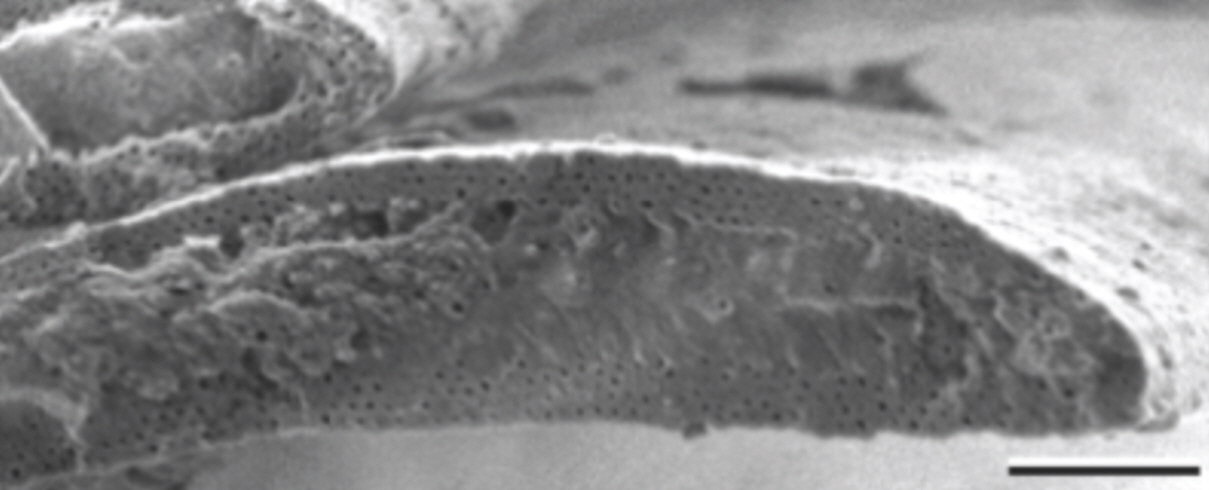
Figure 5.
An overview of varying structures in a feather that produce structural support and impart colours to itself. (a) A single thin layer. Two light waves reflected at the top and bottom surfaces interfere with each other. (b) A periodic multilayered structure. i1 and i2 indicate interfaces that are separated by one period. (c) A two-dimensional photonic crystal structure. (d) An amorphous network structure of a common kingfisher (Alcedo atthis) feather barb cross-section observed by Scanning Electron Microscopy. Scale bar: 0.5 µm Reprinted from “Mechanisms of Feather Structural Coloration and Pattern Fomation in Birds, by Yoshioka & Akiyama, 2021, Springer Singapore, Copyright 2021 by Springer Singapore of publisher”


Figure 6.
Reference webpage for feather identification. Retrieved from https://www.featherbase.info. Copyright 2023 by Featherbase.
Figure 7.
Reference birds sample for Smithsonian Institution, Feather Identification Lab. Retrieved from www.naturalhistory.si.edu. Copyright 2023 by National Museum of Natural History.

Figure 8.
Biological damage case; SEM image of Proctophyllodes huitzilopochtlii mites along the main shaft of a rectrix from an Anna’s hummingbird. Reprinted from “Evaluation of Proctophyllodes huitzilopochtlii on feathers from Anna’s(Calypte anna) and Black-chinned (Archilochus alexandri) Hummingbirds: Prevalence assessment and imaging analysis using light and tabletop scanning electron microscopy, by Y.K.Yamasaki et al., 2018, PLoS ONE 13(2), 9, Copyright 2018 by PLoS ONE.”

Figure 9.
Illustrations of node morphology Reprinted from “Microscopy of Feathers: A Practical Guide for Forensic Feather Identification, by Dove&Koch, 2010, Journal of the American Society of Trace Evidence Examiners 1(1), 26, Copyright 2010 by American Society of Trace Evidence Examiners.”

Figure 10.
Comparison between visible (VIS) and fluorescent responses of a pheasant feather to the UV radiation. (a) Vis-reflected image. (b) UV-reflected image.

Figure 15.
Before and after wet cleaning a peacock tail feather (Pictured by the author, © 2022, Museum of Anthropology, UBC, Canada).

Figure 16.
Before and after stabilizing a crack in a pheasant feather (Pictured by the author, 2023).

Figure 17.
Frontal and rear views of a peacock tail feather stabilized with a Paraloid™ B-72 pellet (Pictured by the author, © 2022, Museum of Anthropology, UBC, Canada).

Figure 18.
Before and after stabilizing a peacock tail feathers with an acrylic thread made from a Paraloid™ B-72 pellet pictured on the left (Pictured by the author, © 2022, Museum of Anthropology, UBC, Canada)

Table 3.
Tools for cleaning of feathers
REFERENCES
American Museum of Natural History, n.d., Feather Cleaning Guideline Request, https://www.amnh.org/research/science-conservation/feather-cleaning-guideline-request/ (Aug 25, 2023)
Backer, K., 1993, Identification guide to European non-passerines; BTO Guide 24, British Trust for Ornithology, Thetford, 7.(in English)
Barton, G. and Weik, S., 1986, Ultrasonic cleaning of ethnographic featherwork in aqueous solutions. Studies in Conservation, 31(3), 125–132. (in English)

Bertasa, M. and Korenberg, C., 2022, Investigating the potential of the Nd:YAG and Er:YAG lasers for the cleaning of feathers: a pilot study. Heritage Science, 2022(10), 1–14. (in English)

Braun, M.S., Sporer, F., Wink, M. and Zimmermann, S., 2018, Birds, feather-degrading bacteria and preen glands: the antimicrobial activity of preen gland secretions from turkeys (Meleagris gallopavo) is amplified by keratinase. FEMS Microbiology Ecology, 94, 1–14. (in English)

Cheung, A., Sam, L., Messerschemidt, L. and Yeung, E., 2014, The analysis an messerschmidtd conservation of a Chinese silk birthday hanging of the Qing dynasty. Studies in Conservation, 59, 28–31.
Ciofini, D., Rossignoli, G., Tosini, I., Lanterna, G. and Siano, S., 2014, Laser ablation treatment of soiled featherworks: The first validation study. Journal of Cultural Heritage, 56, 118–129. (in English)

Dignard, C., Binnie, N., Young, G., Abraham, M. and Scheerer, S., 2003, Cleaning of soiled white Feathers using the Nd:YAG Laser and traditional methods. In: Dickmann K., Fotakis C., Asmus J.F., editors. Lasers in the Conservation of Artworks, Springer, Berlin, 227–235. (in English)
Dove, C. J. and Koch, S. L., 2010, Microscopy of feathers: A practical guide for forensic feather identification. Journal of the American Society of Trace Evidence Examiners, 1(1), 15–16. (in German)
Durrer, H., 1977, Schillerfarben der Vogelfeder als Evolutionsproblem: elektronenmikroskopische Untersuchung der Schillerstrukturen, ihrer Morphogenese und Analyse von Selektionsmechanismen (speziell dargelegt am Beispiel der Hühnervögel), Komm. Gebr. Fretz, Zürich, Druck von Gebrüder AG, Kommissionsverlag von Gebrüder Fretz, Zurich. (in German)
Giraudeau, M., Czirják, G. Á., Duval, C., Bretagnolle, V., Gutierrez, C., Guillon, N. and Heeb, P., 2013, Effect of preen oil on plumage bacteria: An experimental test with the mallard. Behavioural Processes January, 92, 1–5. (in English)

Gu, A., Wang, N., Kong, Y.-J., Hou, J.-Y., Li, G. and Lei, Y., 2021, Analytical investigation of the feather decoration technique of a seventeenth to eighteenth century Chinese imperial hanging screen. Heritage Science, 2021(82), 1–13. (in English)

Hirst, H.R., 1927, Ultra-violet radiation as an aid to textile analysis. Journal of the Textile Institute Transactions, 18(10), 369–375. (in English)
Huth, H.H. and Burkhardt, D., 1972, Der spektrale Sehbereich eines Violettohr-Kolibris. Naturwissenschaften, 59, 650.(in German)

Kim, S., Park, N. and Son, J., 2004, Analysis of Amino Acids. Korean journal of crop science, 49(7), 3–16. (in Korean)
Kim, S.R., 2014, Clothing materials, 3rd ed. Kyomunsa, Paju, 83–85.
Klapšt’Ová, k., Rajchard, J. and Procházka, J., 2015, Species determination of the feathers on native American warbonnets and other objects from the collections of the national museum - Náprstek Museum. Annals of the Naprstek Museum, 36(2), 67–80.
Korea National Park Research Institute, 2019, A field guide to the Buntings of Korea, 17.(in Korean)
Ksepka, Daniel T., 2016, The P enguin’s P alette: More Than Black and White. American Scientist, 104(1), 36–43. doi: 10.1511/2016.118.36. (in English)

Lim, J., Lee, Y. and Lee, H., 2010, A study on the organic remains attached to vertical plate armor from the Three Kingdoms period. Hanguk Kogo-Hakbo, 75, 200–232. (in Korean with English Abstract)
Moreno-Rueda, G., 2017, Preen oil and bird fitness: a critical review of the evidence. Biological Reviews, 92(4), 2131–2143. (in English)


Mullen, P. and Pohland, G., 2007, Studies on UV reflection in feathers of some 1000 bird species: are UV peaks in feathers correlated with violet-sensitive and ultraviolet-sensitive cones? Ibis, 150(1), 59–68. (in English)

National Library of Korea, 2017, Yu Kil-Chun and his vision of transition from oral culture to literary culture, National Museum of Korea, Seoul. https://www.nl.go.kr/ (Aug 28, 2023) (in Korean)
Park, B.-h., 2005, Study on costume designs applying techniques of ostrich feathers craft. Master degree thesis, Ewha Womans University, 71.
Park, D., Cho, I. and Bae, M., 2015, Determination of amino acids on wintertime PM2.5 using HPLC-FLD. Journal of Korean Society for Atmospheric Environment, 31(5), 482–492. (in Korean with English Abstract)

Park, S., 2020, Reflection spectrum analysis of the morphology of melanosome in biological tissue by using FDTD simulation -Classification of black-billed Magpie according to the habitat-. Master degree thesis, Kookmin University, Seoul, 1–22 p. (in Korean with English Abstract)
Pearlstein, E., 2017, The conservation of feathers from central and South America, Archetype Publications, London. (in English)
Pearlstein, E., Hughes, M., Mazurek, J., McGraw, K., Pesme, C., Riedler, R. and Gleeson-Garibay, M., 2014a, Correlations between photochemical damage and UV fluorescence of feathers. In: ICOM-CC 17th Triennial Conference Preprints; Melbourne. 15-19. September 2014; 1–8. (in English)
Pearlstein, E., Hughes, M., Mazurek, J., McGraw, K., Pesme, C., Riedler, R. and Gleeson-Garibay, M., 2014b, Ultraviolet-induced visible fluorescence and chemical analysis as tools for examining featherwork. Objects Specialty Group Postprints, 21, 143–179. (in English)

Pohland, G. and Mullen, P., 2006, Preservation agents influence UV-coloration of plumage in museum bird skins. Journal of Ornithology volume, 147, 464–467. (in English)

Salzman, E. and McCarthy, B., 2002, Rhapsody in blue: Kingfisher feather cloisonné in the Arthur M. Sackler Gallery. The Textile Sepecialty Group Postprints, 9, 45–56. (in English)
Sandilands, V., Savory, J. and Powell, K., 2004, Preen gland function in layer fowls: factors affecting morphology and feather lipid levels. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 137(1), 217–225. (in English)

Silveira, L. d., 1997, A note on the poultice cleaning of feathers using Laponite RD gel. Studies in Conservation, 42(1), 11–16. (in English)

Stravenga, D. G., Leetouwer, H. L. and Wilts, B. D., 2018, Magnificent magpie colours by feathers with layers of hollow melanosome. Journal of Experimental Biology, 221(4), doi: 10.1242/JEB.174656. (in English)
Yamasaki, Y. K., Graves, E. E., Houston, R. S., OConnor, B. M., Kysar, P. E., Straub, M. H., Foley, J. E. and Tell, L. A., 2018, Evaluation of Proctophyllodes huitzilopochtlii on feathers from Anna’s (Calypte anna) and black-chinned (Archilochus alexandri) Hummingbirds: Prevalence assessment and imaging analysis using light and tabletop scanning electron microscopy. PLoS ONE, 13(2), 1–18. (in English)

Yoshioka, S. and Akiyama, T., 2021, Mechanisms of Feather Structural Coloration and Pattern Formation in Birds. In: Hashimoto H., Goda M., Futahashi R., Kelsh R., Akiyama T., editors. Pigments, Pigment Cells and Pigment Patterns, Springer Singapore, Singapore, 343–366. (in English)
- TOOLS
-
METRICS

-
- 0 Crossref
- 576 View
- 14 Download
-
Related articles in
J. Conserv. Sci. -
Anoxia Techniques to Eradicate Insects for Conservation of Cultural Properties in Museums2011 ;27(2)
The Consolidation Medium for the Conservation of Mud Wall Painting2002 ;11(1)
Geotechnical Consideration on the Conservation of the Muryong Royal Tomb1999 ;8(1)